liamocin是出芽短梗霉(Aureobasidium pullulans)的某些菌株在发酵过程中分泌的一种多元醇酯,现已证明其具有抗肿瘤、抗菌、表面活性剂等多种作用。我们筛选获得一株出芽短梗霉liamocin高产菌株,对其产liamocin的发酵条件进行初步研究,并建立了一种滤纸片法测定liamocin含量的简便方法。研究结果显示:菌株以葡萄糖、蔗糖、木糖作碳源,都可以有效产生liamocin; 酵母提取物、硝酸钠、玉米浆是比较适合的氮源; 发酵过程中培养基pH值变化较大,培养基初始pH值为4~8时,liamocin都可以较好地产出; 培养基装量对liamocin产量的影响较大。该研究结果可为liamocin发酵条件的进一步优化提供参考。
Liamocin, a kind of polyol lipid produced by some strains of Aureobasidium pullulans during fermentation, has been proved to have anticancer activity, antibacterial activity and can function as biosurfactant. The research screened out a high-producing strain of liamocin, conducted a preliminary study on media and culture conditions for liamocin production, and developed a simple method for determining the amount of liamocin by filter paper. The results showed that glucose, sucrose and xylose were efficient carbon sources, and yeast extract, NaNO3 and corn steep liquor were efficient nitrogen sources for liamocin production. During the fermentation, pH value of the media changed greatly, with the initial pH of media ranged from 4 to 8, liamocin could be efficiently produced. Moreover, the filling volume of the media affected the production of liamocin greatly. This study has paved a foundation for further fermentation optimization of liamocin fermentation conditions.
出芽短梗霉(Aureobasidium pullulans)广泛用于普鲁兰多糖(pullulan)[1-3]和聚苹果酸(poly malic acid)[4-5]的生产,1993年日本的Nagata等[6]在研究出芽短梗霉发酵产聚苹果酸时,发现某些菌株可分泌一种密度比水重的多元醇酯。该物质在静止时沉在培养基的底部,因此又称重油(heavy oil),后被称作liamocin。结构分析显示该多元醇酯头部基团为甘露醇或阿拉伯醇,尾部为3,5-二羟基癸酸的三联体或四联体[7-8]。现已证明该多元醇酯具有抗肿瘤[9-10]、抗菌[11]、表面活性剂[10,12]等多种作用,具有广泛的应用前景。目前出芽短梗霉发酵产liamocin的研究刚刚起步,已有研究主要集中在结构鉴定、生物活性测定等方面,关于发酵条件的研究非常少。Price等[13]研究了不同糖和多元醇作为碳源对出芽短梗霉菌株NRRL50380产liamocin的影响,结果表明包括葡萄糖、蔗糖、木糖、果糖等在内的多种糖都可以产liamocin,其中以蔗糖的产量较高。使用不同碳源时,liamocin的结构有所不同,其结构主要与多元醇有关,与尾部的关系不大。Leathers等[14]对出芽短梗霉以燕麦木聚糖、玉米纤维、小麦秸秆水解物等生物质发酵产liamocin进行了研究,结果表明,燕麦木聚糖和小麦秸秆水解物可以较好地生产liamocin。以上主要是关于碳源的研究,而其他发酵条件诸如氮源、pH值、溶氧等对liamocin的影响尚缺乏系统的研究。本课题组在进行聚苹果酸发酵研究的时候分离到一株产liamocin的菌株,为提高其发酵产量,对其发酵条件进行了初步研究。
1 材料与方法1.1 微生物出芽短梗霉(Aureobasidium pullulans)(本实验室筛选保存),马铃薯葡萄糖琼脂培养基(PDA)冰箱斜面保存,每2个月转接1次。
1.2 培养基1.2.1 斜面保藏培养基马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,水1 000 mL,琼脂15~20 g,pH值自然。
1.2.2 种子培养基葡萄糖50 g,蛋白胨1 g,酵母提取物1 g,KH2PO4 0.5 g,MgSO4·7H2O 0.4 g,NaCl 1 g,水1 000 mL。
1.2.3 摇瓶发酵培养基葡萄糖50 g,蛋白胨0.6 g,酵母提取物0.6 g,KH2PO4 0.4 g,MgSO4·7H2O 0.4 g,NaCl 1 g,水1 000 mL。其中,在进行碳源优化时,其他成分均不变,使用质量浓度50 g/L的不同碳源; 在进行氮源优化时,其他成分均不变,使用质量浓度1 g/L的不同氮源。
1.3 培养方法1.3.1 斜面培养菌种接种于PDA培养基,28 ℃培养箱中培养2 d备用。
1.3.2 种子培养250 mL三角烧瓶装入50 mL培养基,接入两环培养好的斜面菌种,于28 ℃、180 r/min摇床培养2 d。
1.3.3 摇瓶发酵培养250 mL三角烧瓶装入50 mL培养基,接入2 mL培养好的种子培养液,于28 ℃、180 r/min摇床培养8 d。培养基装量在优化时有所不同。所有试验均做3个摇瓶,结果取平均值。
1.4 pH值的测定用数显台式酸度计(上海越平PHS-3C)进行测定。
1.5 liamocin的测定方法liamocin的测定采取滤纸吸取称重法。滤纸在60 ℃的烘箱中烘干至恒重,称取滤纸重量得W1。摇瓶发酵结束后室温静置1 h,使liamocin沉淀聚集在摇瓶底部,小心地将上层清液缓慢倒出,然后加入少量蒸馏水轻轻摇晃洗涤liamocin,静置几分钟,将上层清液小心地倒出,如此反复洗涤3~5次,使上层清液澄清为止。将预先干燥的滤纸过滤吸取liamocin,尽量使liamocin完全吸收到滤纸上去,然后将含有liamocin的滤纸片置于60 ℃的烘箱中烘3~4 h,称重得到W2。发酵液中liamocin质量浓度的计算公式为:liamocin质量浓度(g/L)=(W2-W1)/摇瓶中发酵液体积×1 000,其中(W2-W1)/摇瓶中发酵液体积为每毫升发酵液中的liamocin克数,换算成1 L中的含量则乘以1 000。
2 结果与讨论2.1 liamocin测定方法的建立liamocin的测定文献中均采用有机溶剂提取法[8,10],即发酵结束后用甲基乙基酮提取发酵液及菌体中的liamocin,先用脱水剂除去liamocin中的水,然后采用旋转蒸发或气流干燥的方法将有机溶剂除去,最后称重。这种方法操作比较复杂,所需时间也较长,不太适合发酵优化时进行大量样品的测定。根据liamocin的特点,本课题组建立了一种较为简单快速的方法,即滤纸片吸取称重法,其具体操作流程和条件见1.5节。该方法仅吸取发酵液中的liamocin进行测定,而菌体中尚未分泌出来的liamocin则无法测定。因此,相对于有机溶剂提取法,该方法测定的数值会偏低。另外,该方法是根据干燥前后的重量差来计算liamocin含量的,因此,干燥条件的控制可能会影响最终的测定结果。但只要严格控制固定的干燥条件,该方法用于发酵优化中liamocin的测定还是可行的。图1和图2分别为发酵液中和滤纸吸取后liamocin的状态。
2.2 liamocin发酵条件的优化2.2.1 不同碳源对liamocin产量的影响
分别以质量浓度50 g/L的葡萄糖、蔗糖、木糖、麦芽糖、果糖和阿拉伯糖为碳源进行摇瓶发酵试验,其产liamocin情况见表1。
由表1可知,麦芽糖作碳源的时候liamocin的产量最高,木糖、蔗糖和葡萄糖作碳源时,菌株也能较好地产liamocin,产量均在2.5~3.5 g/L,而果糖和阿拉伯糖的产量则较低,因此不适合产liamocin。从发酵过程来看,虽然麦芽糖为碳源liamocin产量最高,但麦芽糖并不是最先产生liamocin的。葡萄糖和蔗糖先于麦芽糖产liamocin,但发酵结束时产量却不高。分析其原因可能是在发酵后期,由于碳源的缺乏,liamocin被作为一种备用碳源而被利用。目前,已有文献主要使用葡萄糖[8]和蔗糖[7,15]作为碳源,其中尤以蔗糖为多。由表1可以看出,木糖作为碳源也能够较好地产生liamocin,虽然麦芽糖的产量比较高,但因其价格较高,不太适合大规模生产的需要。因此,出芽短梗霉产liamocin的适宜碳源可选用葡萄糖、蔗糖和木糖。
表1 发酵过程中不同糖产liamocin的情况
Table 1 Liamocin production in the fermentation process with different carbon sources
2.2.2 不同氮源对liamocin产量的影响
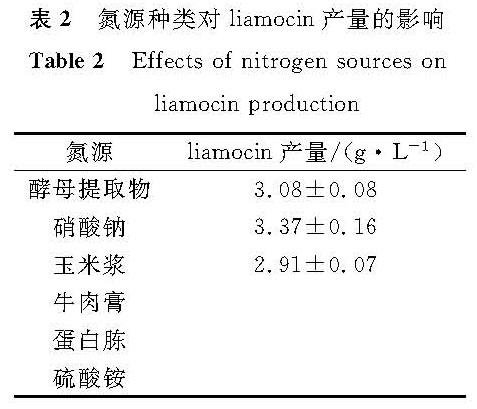
以质量浓度50 g/L的葡萄糖作为碳源,分别以质量浓度1 g/L的酵母提取物、硝酸钠、玉米浆、牛肉膏、蛋白胨和硫酸铵为氮源进行摇瓶发酵试验,其产liamocin情况见表2。
由表2可知,在所试验的氮源中,酵母提取物、硝酸钠和玉米浆作氮源时,菌株能够较好地产生liamocin,牛肉膏、蛋白胨和硫酸铵作氮源时菌株则不产生liamocin。酵母提取物、硝酸钠也被其他研究者[8]广泛用于liamocin的生产,蛋白胨也在使用,但通常是与酵母提取物一起使用[7,15]。氮源对liamocin产量的影响比较复杂,不仅仅受氮源种类的影响,氮源质量浓度、C/N比值,甚至不同氮源使用导致的菌体量生长情况、培养基pH值变化等都会影响产量。因此,今后有必要对氮源的影响作进一步研究。
2.2.3 培养基初始pH值对liamocin产量的影响
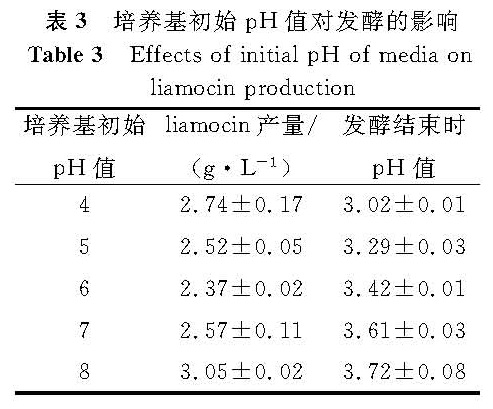
调整培养基的初始pH值分别为4、5、6、7、8进行发酵试验,发酵结束时测定liamocin产量和发酵液pH值,测定结果见表3。
由表3可知,培养基初始pH值在4~8范围内对liamocin产量的影响并不是很大,初始pH值为8时产量略高于其他pH值。对发酵结束时的pH值进行测定,结果表明在发酵过程中,培养基的pH值变化幅度比较大,无论初始pH值为多少,发酵结束时培养基的pH值均降到3~4之间,这在一定程度上解释了为什么初始pH值对liamocin的产量影响不大。因摇瓶发酵无法在线进行pH值的调节,pH值对liamocin产量的影响有待通过发酵罐培养进一步研究。
2.2.4 培养基装量对liamocin产量的影响
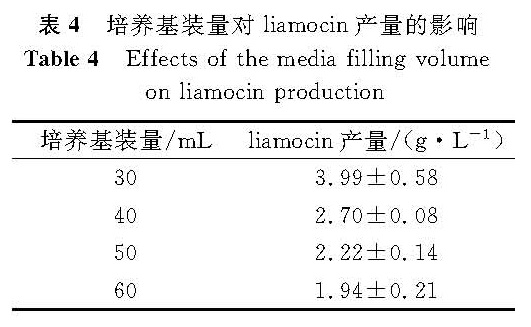
以250 mL三角烧瓶进行摇瓶培养,调整培养基装量分别为30、40、50、60 mL,发酵结果见表4。由表4可见,随着培养基装量的增加,liamocin产量有明显的下降趋势,此结果揭示溶解氧可能对liamocin的产生具有较大的影响。但目前文献中尚无关于装量或溶解氧情况对liamocin发酵影响的报道,因此,此结论有待通过发酵罐发酵进一步验证。
3 结 论本研究建立了一种滤纸片快速测定liamocin含量的方法,该方法比有机溶剂提取法操作简便,更适合用于发酵优化时大批量样品的测定。通过发酵条件的初步研究,得到了适合liamocin发酵的一些基本数据:葡萄糖、蔗糖、木糖作碳源,菌株都可以有效产生liamocin,氮源以酵母提取物、硝酸钠、玉米浆较好,发酵过程中培养基pH值变化较大,发酵过程中pH值的及时有效控制有可能进一步提高liamocin产量,培养基装量对liamocin产量的影响较大。该研究结果为liamocin发酵条件的进一步优化提供了参考。但该研究结果均为摇瓶发酵得到,因摇瓶发酵中pH值、溶解氧等均无法在线监测和调节,有些结论还需要通过发酵罐发酵进一步验证。
- [1] CHI Z, WANG F, CHI Z, et al. Bioproducts from Aureobasidium pullulans, a biotechnologically important yeast[J].Applied Microbiology and Biotechnology,2009,82(5):793.
- [2] LI Y, CHI Z, WANG G Y, et al. Taxonomy of Aureobasidium spp. and biosynthesis and regulation of their extracellular polymers[J].Critical Reviews in Microbiology,2015,41(2):228.
- [3] SINGH R S, SAINI G K, KENEDY J F. Pullulan: microbial sources, production and applications[J].Carbohydrate Polymers,2008,73(4):515.
- [4] LEATHERS T D, MANITCHOTPISIT P. Production of poly(β-L-malic acid)(PMA)from agricultural biomass substrates by Aureobasidium pullulans[J].Biotechnology Letters,2013,35(1):83.
- [5] WEI P L,CHENG C, LIN M, et al. Production of poly(malic acid)from sugarcane juice in fermentation by Aureobasidium pullulans: kinetics and process economics[J].Bioresource Technology,2017,224:581.
- [6] NAGATA N, NAKAHARA T, TABUCH T. Fermentative production of PMA, a polyelectrolytic biopolyester by Auerobasidium sp.[J].Bioscience Biotechnology and Biochemistry,1993,57(4):638.
- [7] PRICE N P J, MANITCHOTPISIT P, VERMILLION K E, et al. Structural characterization of novel extracellular liamocins(mannitol oils)produced by Aureobasidium pullulans strain NRRL 50380[J].Carbohydrate Research,2013,370:24.
- [8] KUROSAWA T, SAKAI K, NAKAHARA T, et al. Extracellular accumulation of the polyol lipids, 3,5-dihydroxydecanoyl and 5-hydroxy-2-decenoyl esters of arabitol and mannitol, by Aureobasidium sp.[J].Bioscience Biotechnology and Biochemistry,1994,58(11):2057.
- [9] ISODA H, NAKAHARA T. Antiproliferative effect of polyol lipids, 3,5-dihydroxydecanoyl and 5-hydroxy-2-decanoyl esters of arabitol and mannitol on lung cancer cell line A549[J].Journal of Fermentation and Bioengineering,1997,84(5):403.
- [10] MANITCHOTPISIT P, PRICE N P J, LEATHERS T D, et al. Heavy oils produced by Aureobasidium pullulans[J].Biotechnology Letters,2011,33(6):1151.
- [11] BISCHOFF K M, LEATHERS T D, PRICE N P J, et al. Liamocin oil from Aureobasidium pullulans has antibacterial activity with specificity for species of Streptococcus[J].Journal of Antibiotics,2015,68(10):642.
- [12] KIM J S, LEE I K, YUN B S. A novel biosurfactant produced by Aureobasidium pullulans L3-GPY from a tiger lily wild flower, lilium lancifolium thunb[J].Plos One,2015,10(4):e0122917.
- [13] PRICE N P J, BISCHOFF K M, LEATHERS T D, et al. Polyols, not sugars, determine the structural diversity of anti-streptococcal liamocins produced by Aureobasidium pullulans strain NRRL 50380[J].Journal of Antibiotics,2016,70(2):1.
- [14] LEATHERS T D, PRICE N P J, MANITCHOTPISIT P, et al. Production of anti-streptococcal liamocins from agricultural biomass by Aureobasidium pullulans[J].World Journal of Microbiology and Biotechnology,2016,32(12):199.
- [15] MANITCHOTPISIT P, WATANAPOKASIN R, PRICE N P J, et al. Aureobasidium pullulans as a source of liamocins(heavy oils)with anticancer activity[J].World Journal of Microbiology and Biotechnology,2014,30(8):2199.
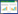 图 1 发酵液中liamocin的状态
Fig.1 Liamocin in the broth
图 1 发酵液中liamocin的状态
Fig.1 Liamocin in the broth