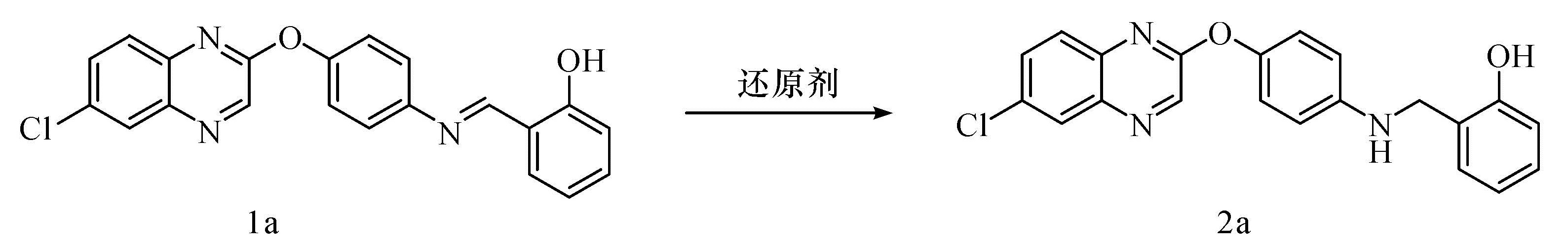
研究一种在室温、无溶剂条件下以硼氢化钠为还原剂还原喹喔啉衍生物碳氮双键的方法。考察还原剂、添加剂、溶剂、反应时间和温度对反应的影响。给出反应的优化条件,即以硼氢化钠(2当量)为还原剂,硅胶为添加剂,它们的质量比为1:3时,在室温碾磨0.1 h,产物收率可达90%。目标产物经过了1HNMR、13CNHM和HRMS确证。该合成方法具有条件温和、操作简单、反应时间短、产率高及对环境友好等优点,是一种高效的亚胺还原方法。
A method for reduction of carbon-nitrogen double bonds of quinoxaline derivatives was studied using sodium borohydride as reducing agent under solvent-free conditions at the room temperature. The effects of reducing agent, additive, solvent, reaction time and temperature on reaction were investigated. The results showed that the optimum reaction conditions were 1:3 mass ratio of borohydride(2.0 eq )as reducing agent and silica gel as additive; 90% yield was obtained under milling at the room temperature for 0.1 hour. The products were identified by 1HNMR、13CNMR and HRMS. This synthetic method boasts mild conditions, simple operation, short reaction time, high yield and eco-friendliness, and proves to be a highly efficient method for reduction of imines.
胺类化合物在天然产物、医药[1]和农药[2]中有着非常广泛的应用,而亚胺还原得到相应的胺是现代有机合成中形成C—N键的一种非常重要的方法,常用的方法有Pd,Ni,Pt等金属催化的氢化法[3]和金属氢化物参与的还原法。前者受限于一些对还原剂敏感的官能团[4],如碳碳双键、三键以及硝基、氰基、呋喃基等基团,而后者已发展出大量不同种类的还原剂。已见报道的还原剂有NaBH[5]4、NaBH(OAc)[6]3、NaBH3CN[7]、(n-Bu)4NBH3CN[8]、NaBH4-NiCl[9]2、NaBH4-ZnCl[10]2、NaBH4-ZrCl[11]4、Ti(OiPr)4-NaBH[12]4、Cu(PPh3)2BH[13]4、Zr(BH4)2Cl2(dabco)[14]2、ZnBH4-SiO[15]2、Et3SiH-CF3CO2H[16]、嘧啶-硼烷[17]、甲基吡啶-硼烷[18]、有机硅(PMHS)-Ti(OiPr)[19]4等,但是上述还原剂都存在着一些不足之处,例如,NaBH3CN等还原试剂在后处理过程中产生极毒的氰化物,其他一些氢化物如硼氢化锌[20]、硼化镍[21]和(PMHS)-Ti(OiPr)[22]4等对含有羰基、酯基、硝基的亚胺结构不能进行选择性还原。
无溶剂合成法由于在反应过程中不使用有机溶剂,具有反应速度快、反应选择性好和后处理简单等优点,还可以得到一些常规液相反应得不到的产物而受到人们广泛的关注[23]。2005年,Cho[24]小组报道了无溶剂条件下以硼氢化钠为还原剂选择性还原亚胺化合物的方法,该方法适用于多种对还原剂敏感的官能团,反应时间短,条件温和,不失为一种还原亚胺的有效方法。
喹喔啉类化合物是一类有应用价值的杂环化合物,具有多种生物活性,如氯喹喔啉衍生物是一类重要的除草剂[25]。我们在生物活性分子的研究中,设计了含氯喹喔啉结构单元的希夫碱。由于此类化合物的还原反应还未见文献报道,我们尝试在室温、无溶剂条件下采用研磨法还原希夫碱,并顺利得到了还原产物,本文报道相应的研究结果。
1 试验部分1.1 仪器与试剂1H NMR和13C NMR在Bruker Advance DMX400(400M)上测定,CDCl3为溶剂,TMS为内标; 高分辨质谱在HP5973GCMS气相色谱质谱联用仪上进行测定。反应进程用TLC跟踪检测,用紫外灯或者碘显色。实验所用试剂均为市售AR或CP试剂。
1.2 试验方法1.2.1 还原剂的选择
将还原剂20 mmol和四氢呋喃20 mL加入反应瓶中,搅拌均匀后再加入化合物1a 10 mmol和5滴甲醇继续搅拌30 min。反应完成后真空旋蒸除去溶剂,加入10 mL 水和10 mL乙酸乙酯,抽滤,再用20 mL水和30 mL乙酸乙酯洗涤滤饼,有机相用饱和食盐水洗涤,无水硫酸镁干燥,旋蒸除去溶剂,经乙醇重结晶得到目标产物2a,具体如表1所示。
1.2.2 无溶剂反应优化将硼氢化钠757 mg(20 mmol)和添加剂2.27 g在研钵中研磨,研磨均匀后再加入化合物1a 10 mmol和5滴甲醇继续研磨6~10 min。反应毕,加入10 mL 水和10 mL乙酸乙酯,抽滤,再用20 mL水和30 mL乙酸乙酯洗涤滤饼,有机相用饱和食盐水洗涤,无水硫酸镁干燥,旋蒸除去溶剂,经乙醇重结晶得到目标产物2a,具体如表1所示。
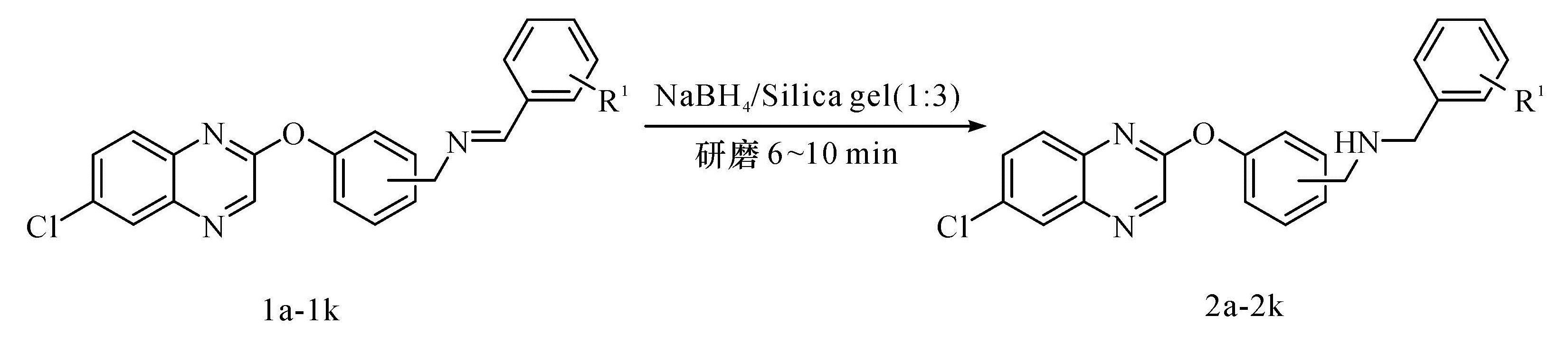
1.2.3 反应底物对还原反应的影响
将硼氢化钠757 mg(20 mmol)和硅胶2.27 g在研钵中研磨,研磨均匀后再加入化合物1a—1k10 mmol和5滴甲醇继续研磨6~10 min。反应毕,加入10 mL水和10 mL乙酸乙酯,抽滤,再用20 mL水和30 mL乙酸乙酯洗涤滤饼,有机相用饱和食盐水洗涤,无水硫酸镁干燥,旋蒸除去溶剂,经乙醇重结晶得到目标产物2a—2k,具体如表2所示。
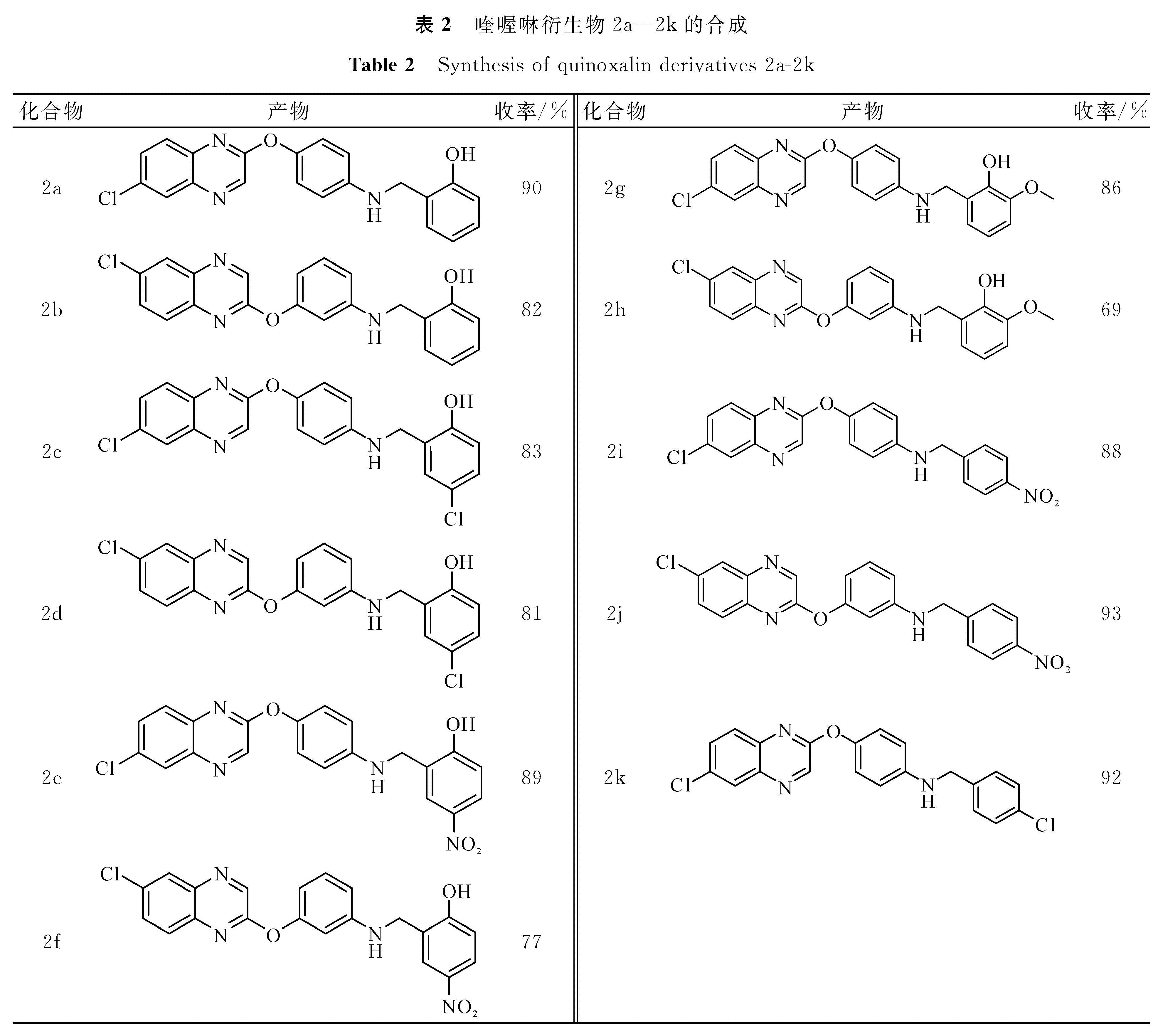
2a:黄色固体,产率90%; 熔点197~198 ℃; 1H NMR(400 MHz,CDCl3)δ:8.68(s, 1H),8.05(s, 1H),7.70(d,J=8.4 Hz,1H),7.60(d,J=6.8 Hz,1H),7.38~7.32(m,2H),7.16(d,J=8.4 Hz,3H),6.92(d,J=6.4 Hz,3H),4.46(s,2H); 13C NMR(100 MHz,CDCl3)δ:157.8,155.0,153.5,148.7,140.0,139.6,138.4,132.9,131.5,130.2,129.2,128.8,127.8,122.8,120.1,116.4,112.7,108.1,44.3; HRMS(EI-TOF)理论值C21H16ClN3O2(M+)377.093 1,实测值377.093 3。
2b:橘红色固体,产率82%; 熔点136~137 ℃; 1H NMR(400 MHz,CDCl3)δ:8.65(s,1H),8.04(s,1H),7.69(d,J=9.2 Hz,1H),7.60(d,J=7.6 Hz,1H),7.29(d,J=8.0 Hz,1H),7.21~7.13(m,2H),6.88~6.83(m,2H),6.77~6.71(m,3H),4.38(s,2H); 13C NMR(100 MHz,CDCl3)δ:156.8,156.0,153.5,148.8,140.0,139.6,138.4,132.9,131.1,130.2,129.2,128.9,128.8,127.8,122.8,120.1,116.4,112.7,112.6,108.1,47.6; HRMS(EI-TOF)理论值C21H16ClN3O2(M+)377.093 1,实测值377.093 0。
2c:白色固体,产率83%; 熔点205~206 ℃; 1H NMR(400 MHz,CDCl3)δ:9.89(s,1H),8.79(s,1H),8.08(s,1H),7.71(s,2H),7.21(d,J=6.4 Hz,1H),7.08~7.06(m,1H),7.01(d,J=8.8 Hz,2H),6.83(d,J=8.8 Hz,1H),6.61(d,J=8.8 Hz,2H),4.19(s,2H); 13C NMR(100 MHz,CDCl3)δ:158.4,147.1,147.0,145.0,144.2,140.1,139.6,138.5,132.5,131.3,129.3,128.7,127.8,127.6,123.9,123.8,123.2,112.4,48.3; HRMS(EI-TOF)理论值C21H15N3O2Cl2(M+)411.054 1,实测值411.054 5。
2d:褐色固体,产率83%; 熔点167~168 ℃; 1H NMR(400 MHz,DMSO-d6)δ:9.82(s,1H),8.79(s,1H),8.09(s,1H),7.72(s,2H),7.18~7.11(m,2H),7.07(dd,J=8.4,J=2.4 Hz,1H),6.78(d,J=8.8 Hz,1H),6.51~6.43(m,3H),6.37(t,J=8.0 Hz,1H),4.17(s,2H); 13C NMR(100 MHz,DMSO-d6)δ:159.2,157.0,147.1,144.9,140.5,139.8,138.4,132.7,132.0,131.3,129.6,128.8,127.8,126.7,122.9,121.2,119.0,116.5,115.8,112.6,45.9; HRMS(EI-TOF)理论值C21H15Cl2N3O2(M+)411.054 1,实测值411.053 6。
2e:黄色固体,产率89%; 熔点199~200 ℃; 1H NMR(400 MHz,CDCl3)δ:8.68(s,1H),8.15(d,J=6.4 Hz,2H),8.05(s,1H),7.68(d,J=8.8 Hz,1H),7.61~7.58(m,1H),7.19(d,J=8.8 Hz,2H),6.97~6.93(m,3H),4.57(s,2H); 13C NMR(100 MHz,CDCl3)δ:162.0,157.5,154.0,150.4,141.4,140.1,139.7,138.6,132.1,131.9,130.5,129.3,127.9,127.0,124.7,124.3,115.5,110.1,109.0,105.1,41.2; HRMS(EI-TOF)理论值C21H15ClN4O4(M+)422.078 2,实测值422.078 6。
2f:淡黄色固体,产率77%; 熔点145~146 ℃; 1H NMR(400 MHz,DMSO-d6)δ:11.26(s,1H),8.77(s,1H),8.11~8.08(m,2H),8.02~7.99(m,1H),7.73~7.65(m,1H),7.14(t,J=8.0 Hz,1H),6.95(d,J=8.8 Hz,1H),6.53~6.44(m,4H),4.25(s,2H); 13C NMR(100 MHz,DMSO-d6)δ:158.2,157.0,147.1,144.9,142.5,139.8,138.4,132.7,132.5,131.3,129.6,128.8,127.8,126.7,122.9,121.2,119.0,116.5,115.8,112.6,46.3; HRMS(EI-TOF)理论值C21H15ClN4O4(M+)422.078 2,实测值422.078 9。
2g:黄色固体,产率86%; 熔点181~182 ℃; 1H NMR(400 MHz,CDCl3)δ:8.65(s,1H),8.05(s,1H),7.71(d,J=8.8 Hz,1H),7.59(d,J=8.8 Hz,1H),7.09(d,J=8.0 Hz,2H),6.93(s,1H),6.84(s,2H),6.77(d,J=8.0 Hz,2H),4.41(s,2H),3.91(s,3H); 13C NMR(100 MHz,CDCl3)δ:157.5,146.6,145.8,144.1,143.9,140.1,139.5,138.6,132.4,130.9,128.7,127.7,124.3,122.0,121.1,119.5,114.1,109.9,55.9,44.3; HRMS(EI-TOF)理论值C22H18ClN3O3(M+)407.103 7,实测值407.103 3。
2h:灰色固体,产率69%; 熔点134~135 ℃; 1H NMR(400 MHz,CDCl3)δ:8.62(s,1H),8.03(s,1H),7.71(d,J=9.2 Hz,1H),7.59(d,J=9.2 Hz,1H),7.21(t,J=8.0 Hz,1H),6.90~6.87(m,1H),6.80(d,J=4.8 Hz,2H),6.59(t,J=6.4 Hz,3H),6.05(s,1H),4.36(s,2H),3,87(s,3H); 13C NMR(100 MHz,CDCl3)δ:158.3,155.5,146.7,145.8,144.1,142.9,140.1,139.5,137.6,132.4,130.5,128.7,127.8,124.3,122.0,121.1,119.5,114.1,109.9,57.9,45.3; HRMS(EI-TOF)理论值C22H18N3O3Cl(M+)407.103 7,实测值407.104 1。
2i:桔红色固体,产率88%; 熔点171~172 ℃; 1H NMR(400 MHz,CDCl3)δ:8.64(s,1H),8.21(d,J=8.0 Hz,2H),8.02(s,1H),7.67(d,J=8.8 Hz,1H),7.56(d,J=8.0 Hz,3H),7.08(d,J=8.4 Hz,2H),6.64(d,J=8.4 Hz,2H),4.49(s,2H),4.32(s,1H); 13C NMR(100 MHz,CDCl3)δ:157.4,147.1,147.0,145.0,144.2,140.1,139.6,138.5,132.5,130.9,129.3,128.7,127.8,127.6,123.9,122.2,113.4,47.9; HRMS(EI-TOF)理论值C21H15ClN4O3(M+)406.083 3,实测值406.083 4。
2j:淡黄色固体,产率93%; 熔点137~138 ℃; 1H NMR(400 MHz,CDCl3)δ:8.63(s,1H),8.19(d,J=8.0 Hz,2H),8.04(s,1H),7.66(d,J=9.2 Hz,1H),7.59(d,J=9.2 Hz,1H),7.53(d,J=8.4 Hz,2H),7.22(d,J=8.0 Hz,1H),6.64(d,J=8.0 Hz,1H),6.52(d,J=8.4 Hz,1H),6.46(s,1H),4.48(s,1H),4.39(s,1H); 13C NMR(100 MHz,CDCl3)δ:158.4,147.4,147.0,145.0,144.2,140.1,138.6,138.5,132.7,130.9,129.3,128.2,127.8,125.6,123.9,123.8,122.2,113.4,49.4; HRMS(EI-TOF)理论值C21H15ClN4O3(M+)406.083 3,实测值406.083 7。
2k:淡黄色固体,产率92%; 熔点106~107 ℃; 1H NMR(400 MHz,CDCl3)δ:8.05(s,1H),7.88(s,1H),7.71(d,J=8.8 Hz,1H),7.58(d,J=8.8 Hz,1H),7.24~7.20(m,3H),6.95(d,J=8.0 Hz,2H),6.84(d,J=8.8 Hz,3H),5.20(s,2H); 13C NMR(100 MHz,CDCl3)δ:156.2,152.1,140.3,137.5,136.0,134.2,133.1,131.1,130.1,129.3,129.1,128.4,128.3,127.7,126.8,117.2,53.1; HRMS(EI-TOF)理论值C21H15ClN3O2(M+)395.059 2,实测值395.060 5。
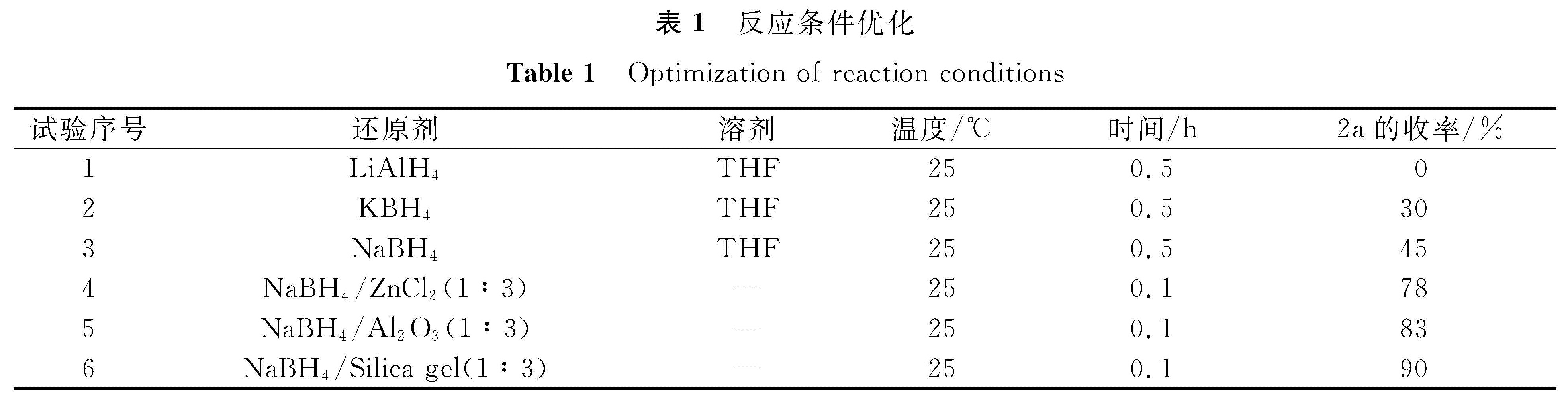
2 结果与讨论2.1 还原剂的选择首先以化合物1a为反应底物进行还原反应的探索研究。如表1所示,在四氢呋喃(THF)溶剂体系中考察了还原剂LiAlH4、KBH4和NaBH4对反应收率的影响,发现LiAlH4对反应极为不利,没有得到相应的目标产物2a; 相反,用还原能力相对较弱的NaBH4以45%的收率得到了目标产物2a。
2.2 无溶剂反应优化进一步的试验表明,在无溶剂反应条件下,以NaBH4为还原剂,不仅能使反应时间缩短,而且收率也显著提高(表1)。因此,还原反应的优化条件是:NaBH4为还原剂,无溶剂条件下研磨6 min。
2.3 反应底物对还原反应的影响在上述最佳反应条件下,考察了各种反应底物对还原反应的影响(表2)。试验结果表明,苯环上取代基的电子效应对反应影响不大,反应均可以顺利进行,并获得相应的目标还原产物。当苯环上带有酚羟基时,除产物2h收率相对偏低外,其他的产物都有较高的收率(2a—2g)。对于苯环上不带酚羟基的底物,该反应也能获得很高的收率(2i—2k)。
3 结 论本研究以具有生物活性的氯喹喔啉衍生物为目标分子,发展了一种以硼氢化钠为还原剂,室温无溶剂还原氯喹喔啉碳氮双键的方法。该方法收率高、条件温和、操作简单、反应时间短、环境友好,是一种高效的亚胺还原方法,为建立分子多样性的化合物库提供了一条有效的途径。
- [1] SLUGGETT G W, ZELESKY T, HETRICK E M, et al. Artifactual degradation of secondary amine-containing drugs during accelerated stability testing when saturated sodium nitrite solutions are used for humidity control [J]. Journal of Pharmaceutical and Biomedical Analysis,2018,149:206.
- [2] MANDALAPU D, KUSHWAHA B, GUPTA S, et al. Substituted carbamothioic amine -1-carbothioic thioanhydrides as novel trichomonicidal fungicides: design, synthesis, and biology[J]. European Journal of Medicinal Chemistry,2018,143:632.
- [3] BHUNIA M, HOTA P K, VIJAYKUMAR G A, et al. A highly efficient base -metal catalyst: chemoselective reduction of imines to amines using an abnormal-nhc-fe(0)complex[J]. Organometallics,2016,35(17):2930.
- [4] KURLOVICH A L, TARASEVICH V A, KOZLOV N G. Synthesis of spirocyclic derivatives of azaphenanthrene containing a hydroxy-m-terphenyl fragment[J]. Russian Journal of Organic Chemistry,2010,46(9):1323.
- [5] HOKAMP T, DEWANJI A, LUBBESMEYER M, et al. Radical hydrodehalogenation of aryl bromides and chlorides with sodium hydride and 1,4-dioxane[J]. Angewandte Chemie-International Edition,2017,56(43):13275.
- [6] YUAN X, ZHANG S J, DU W, et al. Asymmetric diels-alder cycloadditions of trifluoromethylated dienophiles under trienamine catalysis [J]. Chemistry-A European Journal,2016,22(31):11048.
- [7] TONG Q H, YAN T Y, TAO T, et al. Reductive amination combining dimethylation for quantitative analysis of early-stage glycated proteins[J]. Analytical Chemistry,2018,90(6):3752.
- [8] HUTCHINS R O, MARKOWITZ M. Tetraalkylammonium trihydridocyanoborates-versatile, selective reagents for reductive aminations in non-polar media[J]. Journal of Organic Chemistry,1981,46(17):3571.
- [9] LI K X, LIU C C, WANG K, et al. Sodium borohydride-nickel chloride hexahydrate in EtOH/PEG-400 as an efficient and recyclable catalytic system for the reduction of alkenes[J]. RSC Advances,2018,8(14):7761.
- [10] PAN X H, WANG K, YU W S, et al. Synthesis of sitagliptin phosphate by a nabh4/zncl2-catalyzed diastereoselective reduction [J]. Chemistry Letters,2015,44(9):1170.
- [11] KUCUK H B, YASA H, YILDIZ T, et al. Detailed studies on the reduction of aliphatic 3-, 4-, 6-, and 13-oximino esters: synthesis of novel isomeric amino esters, oximino alcohols, and amino alcohols[J]. Synthetic Communications,2017,47(22):2070.
- [12] MIRIYALA B, BHATTACHARYYA S, WILLIAMSON J S. Chemoselective reductive alkylation of ammonia with carbonyl compounds: synthesis of primary and symmetrical secondary amines[J]. Tetrahedron,2004,60(7):1463.
- [13] BHANUSHALI M J, NANDURKAR N S, BHOR M D, et al. Direct reductive amination of carbonyl compounds using bis(triphenylphosphine)copper(I)tetrahydroborate[J]. Tetrahedron Letter,2007,48(7):1273.
- [14] FIROUZABADI H, IRANPOOR N, ALINEZHAD H. Dichlorobis(1,4-diazabicyclo[2.2.2]octane)(tetrahydroborato)-zirconium(IV), [Zr(BH4)(2)Cl-2(dabco)(2)](ZrBDC), as a new, stable, and versatile bench top reducing agent:(1)reduction of imines and enamines, reductive amination of aldehydes and ketones and reductive methylation of amines[J]. Bulletin of the Chemical Society of Japan,2003,76(1):143.
- [15] RANU B C, MAJEE A, SARKAR A. One-pot reductive amination of conjugated aldehydes and ketones with silica gel and zinc borohydride[J]. Journal of Organic Chemistry,1998,63(2):370.
- [16] CHEN B C, SUNDEEN J E, GUO P, et al. Novel triethylsilane mediated reductive N-alkylation of amines: improved synthesis of 1-(4-imidazolyl)methyl-4-sulfonylbenzodiazepines new farnesyltransferase inhibitors[J]. Tetrahedron Letter.2001,42(7):1245.
- [17] BOMANN M D, GUCH I C, DIMARE M. A mild, pyridine-borane-based reductive amination protocol[J]. Journal of Organic Chemistry,1995,60(18):5995.
- [18] SATO S, SAKAMOTO T, MIYAZAWA E, et al. One-pot reductive amination of aldehydes and ketones with alpha-picoline-borane in methanol, in water, and in neat conditions[J]. Tetrahedron,2004,60(36):7899.
- [19] CHANDRASEKHAR S, REDDY C R, AHMED M, et al. A single step reductive amination of carbonyl compounds with polymethylhydrosiloxane-Ti((OPr)-Pr-i)(4)[J]. Synlett,2000(11):1655.
- [20] NARASIMHAN S, BALAKUMAR R. Synthetic applications of zinc borohydride[J]. Aldrichimica Acta,1998,31(1):19.
- [21] REDING M T, BUCHWALD S L. An inexpensive air-stable titanium-based system for the conversion of esters to primary alcohols[J]. Journal of Organic Chemistry,1995,60(24):7884.
- [22] CHO B T, KANG S K. Clean and simple chemoselective reduction of imines to amines using boric acid-activated sodium borohydride under solvent-free conditions[J]. Synlett,2004(9):1484.
- [23] PRASANTH C P, JOSEPH E, ABHIJITH A, et al. Stabilization of nabh4 in methanol using a catalytic amount of naome reduction of esters and lactones at room temperature without solvent-induced loss of hydride[J].Journal of Organic Chemistry,2018,83(3):1431.
- [24] CHO B T, KANG S K. Direct and indirect reductive amination of aldehydes and ketones with solid acid-activated sodium borohydride under solvent-free conditions[J]. Tetrahedron,2005,61(24):5725.
- [25] YADAV R, BHULLAR M S, KAUR S, et al. Weed control in conventional soybean with pendimethalin followed by imazethapyr plus imazamox/quizalofop-p-ethyl[J]. Canadian Journal of Plant Science,2017,97(4):654.
 图 1
图 1