针对石油污染问题,选育高效石油降解菌,为石油污染生物修复提供菌种资源和技术支持。通过连续富集传代培养,从石油污染土壤样品中分离出高效石油降解菌XS -2。经过形态学、生理生化以及16S rRNA序列分析,鉴定XS -2为赤红球菌(Rhodococcus ruber)。该菌的最佳培养条件是培养温度30 ℃、初始培养pH值7.0、石油质量浓度5 g/L,7 d降解率可达65%。经气相色谱(GC)分析,该菌可有效降解碳14、15、16、17的正构烷烃。因此,赤红球菌XS -2在开发研制石油污染生物修复菌剂方面有较好的应用前景。
In response to the oil pollution problem, a highly efficient petroleum-degrading bacterial strain was bred to provide species resources and technical support for bioremediation of oil pollution. Through continuous enrichment subculture, XS -2, the highly efficient petroleum-degrading bacteria was isolated from samples of soil contaminated by petroleum. The strain was identified as Rhodococcus ruber through morphological, physiological and biochemical and 16S rRNA sequence analysis. Its culture conditions were optimized by culture temperature of 30 ℃, initial pH value of 7.0 and petroleum mass concentration of 5 g/L, as a result of which the degradation rate in 7 days could reach up to 65%. Through GC analysis, the strain could effectively degrade n-alkanes with C 14, 15, 16 and 17. Therefore, Rhodococcus ruber XS -2, has sound prospects for application in the aspect of developing bioremediating inoculant of oil pollution.
石油是人类生产、生活中不可或缺的重要能源和工业原料。石油在开采、生产和运输过程中,常伴随由石油泄漏造成的环境污染。据估计,全世界范围内每年约有上千万吨的石油进入水体、土壤等自然环境中[1-3]。石油的主要成分是烷烃、苯、甲苯和二甲苯等复杂芳香烃,如进入食物链会对动物和人体造成损伤。因此,治理石油污染势在必行。石油污染处理常用的方法有物理、化学以及微生物修复法[4],物理、化学修复一般存在成本高、操作复杂、易造成二次污染等缺点,而微生物修复则具有操作简单、作用时间长、安全等优点[5]。微生物降解石油已成为当前石油污染生物修复的重要方法之一[6-7]。因此,本文拟筛选针对降解石油的微生物,以期为环境中石油污染生物修复提供新的菌种资源。
1 材料与方法1.1 材 料1.1.1 样品采集石油污染样品采自石油污染的土壤。采集距地表10 cm左右土层的土壤,装入灭菌袋中,在实验室中除去杂物,低温保存,备用。
1.1.2 石 油石油样品取自唐海冀东油田,室温下为黑色黏稠状物,密度为0.824 g/mL,50 ℃时黏度为8.75 mm2/s,正构烷烃含量50.52%。密封保存。
1.1.3 培养基牛肉膏蛋白胨培养基(简称PB培养基):蛋白胨10 g/L,NaCl 5 g/L,牛肉膏5 g/L; pH值7.0~7.2(固体培养基加1.2%琼脂粉)。Luria-Bertani培养基(简称LB培养基):蛋白胨10 g/L,NaCL 10 g/L,酵母粉10 g/L,pH值7.0~7.2。石油培养基:无机盐基础培养基(简称MSM培养基)[8]加石油5 g/L; pH值7.0~7.5。
1.1.4 主要仪器与设备电子分析天平A210P型,德国赛多利斯公司(Sartorius); BIO-RAD凝胶成像系统,美国伯乐公司(Bio-Rad); OLYMPUS光学显微镜,日本奥林巴斯公司(Olympus); 752型紫外可见分光光度计,上海光谱仪器有限公司; DSQⅡ气相色谱-质谱联用仪,美国赛默飞世尔科技公司(Thermo); SIGMA2-16PK型高速台式离心机,美国西格玛有限公司(Sigma)。
1.2 方 法1.2.1 石油降解菌的筛选将5 g土壤样品加入100 mL石油培养基中,30 ℃、150 r/min摇床培养7 d,连续富集培养3次。采用平板划线法进行分离,30 ℃培养箱培养48 h。选择不同形态的单菌落,分别接种于PB固体平板,30 ℃培养箱培养48 h。对平板细菌进行涂片观察,确认无杂菌后,接种到PB固体斜面进行保存。
将纯化的单菌株于PB液体培养基中活化,吸取10 mL菌液加入到100 mL石油培养基中,对照组直接加入10 mL灭菌后的PB液体培养基,每株菌3个平行,25 ℃、180 r/min培养7 d,期间观察石油形态的变化,并于第7天测石油的降解率。
1.2.2 石油降解菌的鉴定1.
2.2.1 形态学观察将菌株在细菌生长固体平板培养基上培养48 h,经番红染色后,用显微镜观察细胞形态[8]。
1.
2.2.2 生理生化鉴定参照《常见细菌系统鉴定手册》[9]进行鉴定。
1.
2.2.3 分子生物学鉴定利用Ezup柱式细菌基因DNA抽提式试剂盒进行基因组总DNA的提取。将提取的DNA用于16S rDNA PCR扩增,正向引物Pf5'-AGAGTTTGATCCTGGCTCAG-3',反向引物Pr5'-ACGGCTACCTTGTTACGACT-3'。PCR反应条件:95 ℃变性4 min; 95 ℃ 1 min,52 ℃ 1 min,72 ℃ 3 min,32个循环; 72 ℃延伸10 min。PCR产物回收、连接、转化测序由金唯智公司完成。将测序结果在GenBank上进行比对,采用MEGA6.0软件构建系统发育树。
1.2.3 石油降解性能1.2.3.1 菌株XS -2生长曲线 将体积分数为5%的种子液接入LB培养基中,30 ℃、200 r/min摇床培养,每2 h取一次样,用分光光度计测定吸光度值(OD600),3个重复。1.2.3.2 石油标准曲线测定 在0.250 g石油中加入少量正己烷,溶解、定容至50 mL,配成5 000 mg/L的标准溶液。将标准液梯度稀释成质量浓度0、10、20、30、40、50、100、150、200 mg/L。在分光光度计的200~300 nm,对中间质量浓度标准液进行光谱扫描[10],以确定最大吸收峰所用波长。在最大吸收峰波长下测定不同质量浓度标准液的吸光度,以吸光度值为纵坐标,石油质量浓度(mg/L)为横坐标绘制标准曲线。
1.2.3.3 样品预处理 降解后的残油用正己烷进行萃取,在标准曲线测定条件下测定吸光度。1.2.3.4 石油去除率计算 石油去除率=[(石油初始质量浓度-培养液石油质量浓度)/石油初始质量浓度]×100%。
1.2.3.5 残油GC分析 在预处理残油中取1 mL用于GC检测。检测条件参照王婧[4]研究中的GC条件。
1.2.4 菌株XS -2降解石油的影响因素
分别对环境温度、石油质量浓度和培养基初始pH等影响因素进行研究,于第7天测石油的降解率,选出XS -2在各项指标中的最佳值,作为红球菌降解石油的最佳条件。
2 结果与分析2.1 石油降解菌筛选结果通过连续富集传代培养的方法在样品中筛选出高效石油降解菌XS -2,该菌株对石油降解作用明显,如图1所示,24 h内石油完全为絮状物,形成油水混合物。
2.2 石油降解菌筛选结果2.2.1 形态学观察
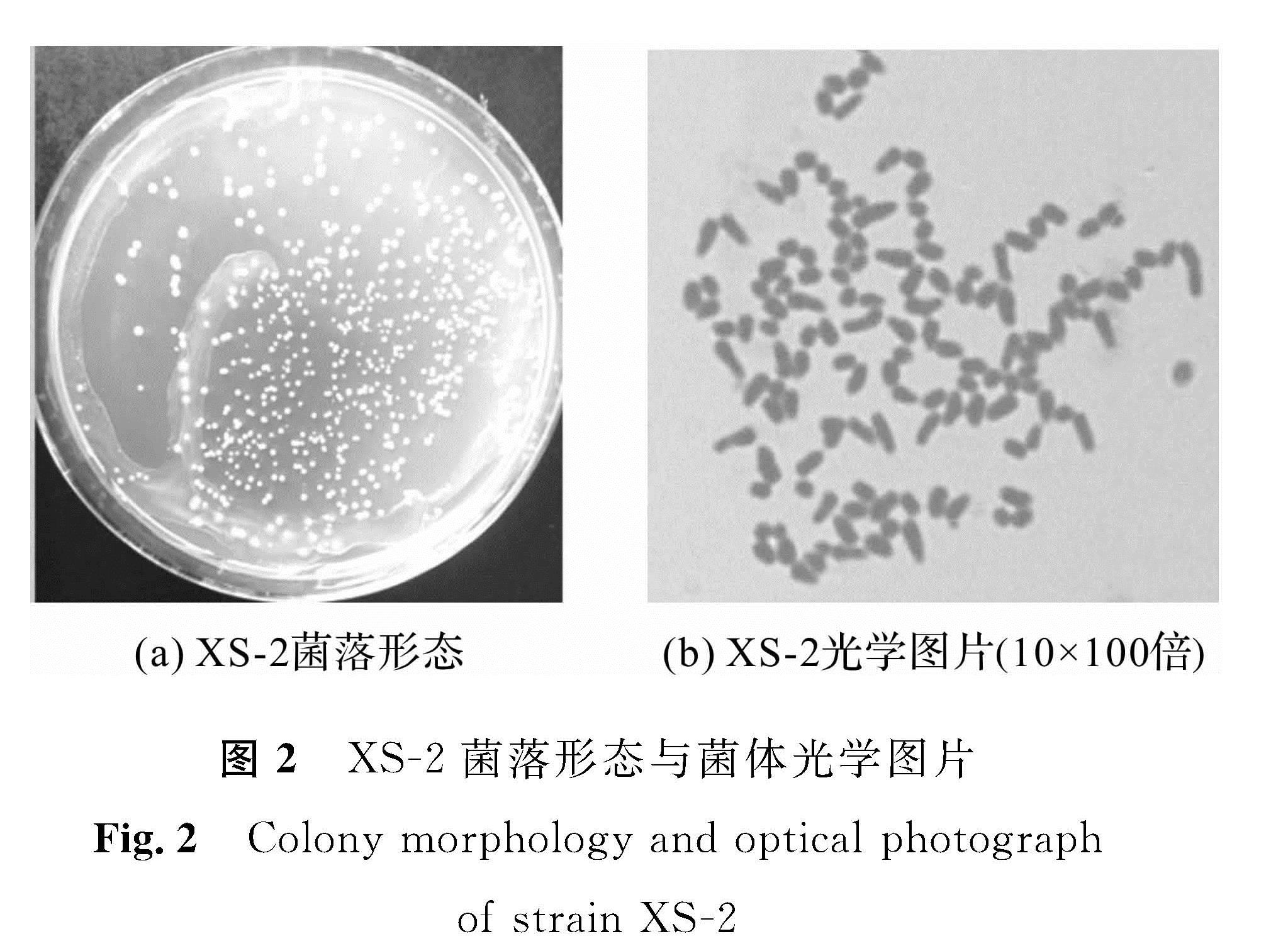
XS -2菌株在PB平板培养24 h,如图2(a)所示,其菌落特征为:菌落圆形、边缘整齐、不透明、表面凸起、干燥、颜色为橙红色。图2(b)是XS -2放大1 000倍菌体图片,生长前期菌体为杆状,随培养时间延长,菌体长度差异较大,变为椭球形。
2.2.2 生理生化鉴定参照《常见细菌系统鉴定手册》[9]中操作方法对菌株XS -2进行以下试验项目的检测,结果如表1所示。细菌XS -2为好氧菌,不产芽孢,革兰氏染色阳性,甲基红反应阴性,V-P反应阳性,氧化酶阳性,接触酶阳性,不能液化明胶,能利用环糊精、柠檬酸盐、核糖、α-D-葡萄糖、D-果糖、丙酮酸、甘露糖,不能利用阿拉伯糖和棉子糖。这与孙磊等[11]分离的赤红球菌(Rhodococcus ruber)S6-2的生理生化特性基本上一致。
2.2.3 分子生物学鉴定
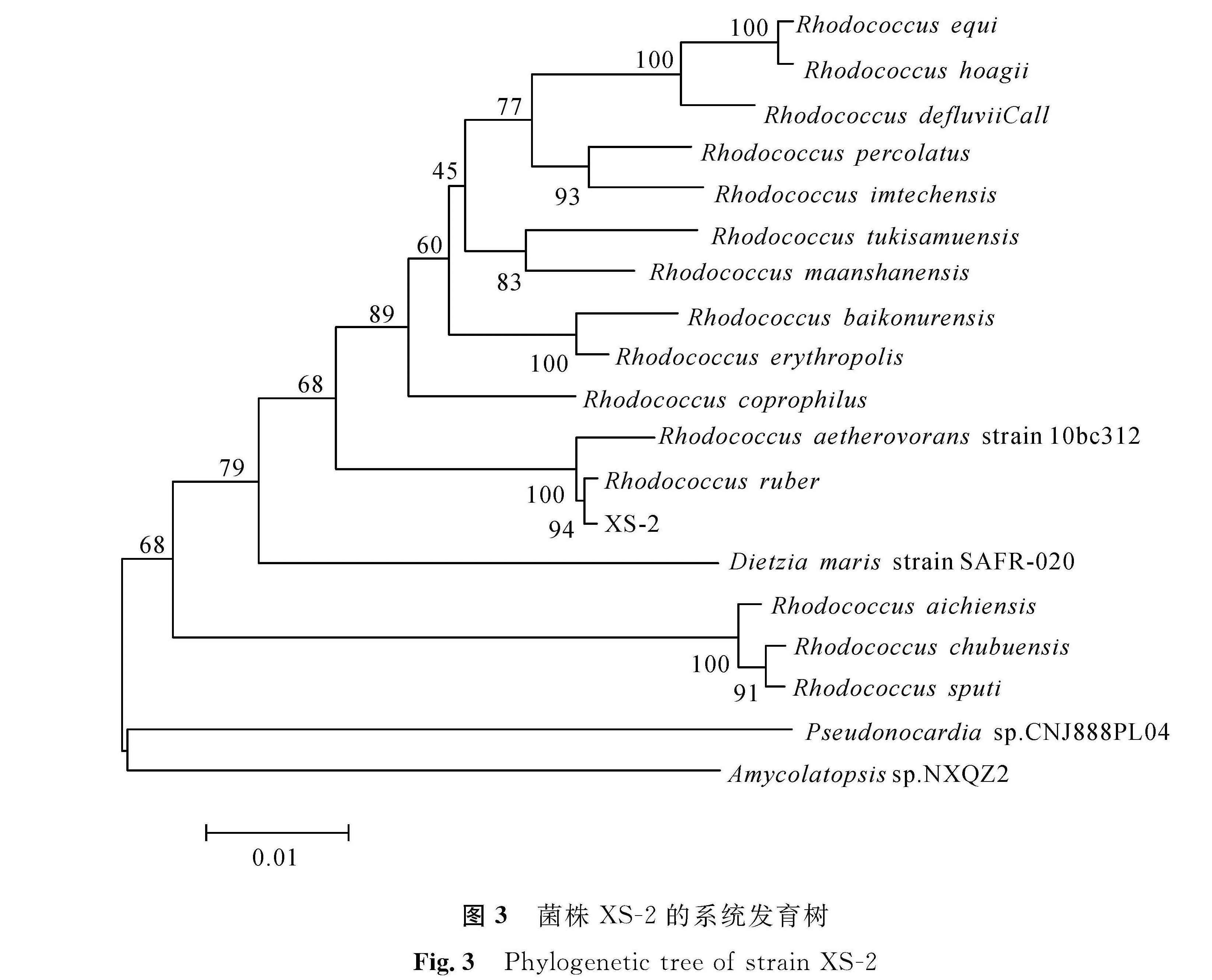
通过16S rRNA测序,得到序列长度为1 500 bp左右的的基因片段,将测序结果上传GenBank,登陆号为MK380013,并与GenBank上的序列进行Blast比对,与红球菌属同源性最高,相似度达到99%。根据细菌形态、生理生化特性、16S rRNA测序结果构建XS -2的系统发育树(图3),综合分析,鉴定该菌株为赤红球菌。
2.2.4 菌株XS -2的生长曲线
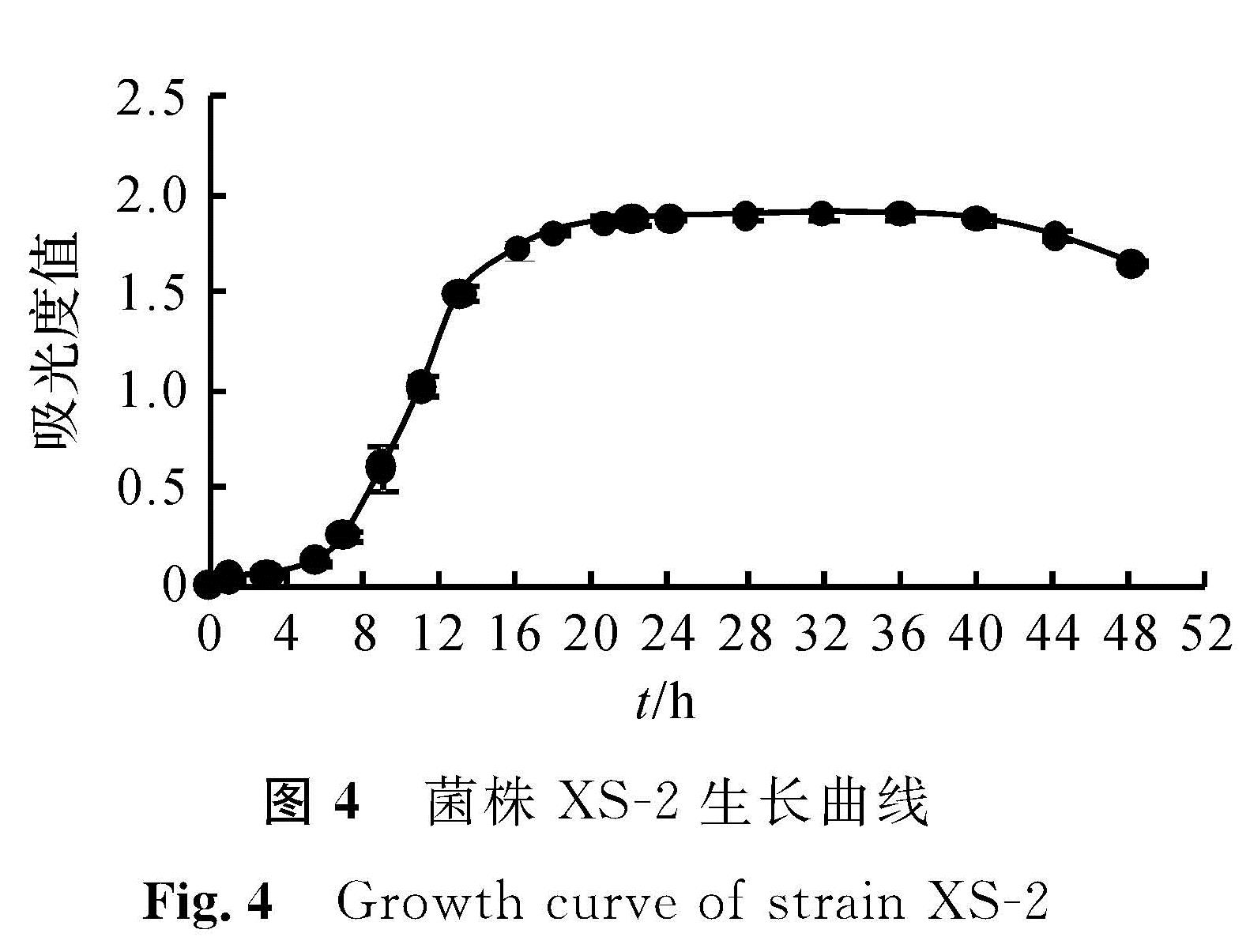
如图4所示,测定了XS -2在LB培养基中培养48 h内的生长量。结果表明,在LB培养基中,0~6 h为细菌生长的延滞期,6~16 h为对数生长期,16~44 h为生长稳定期,44 h以后细菌进入衰亡期。因此,后期试验采用培养16 h的菌液活性最高。
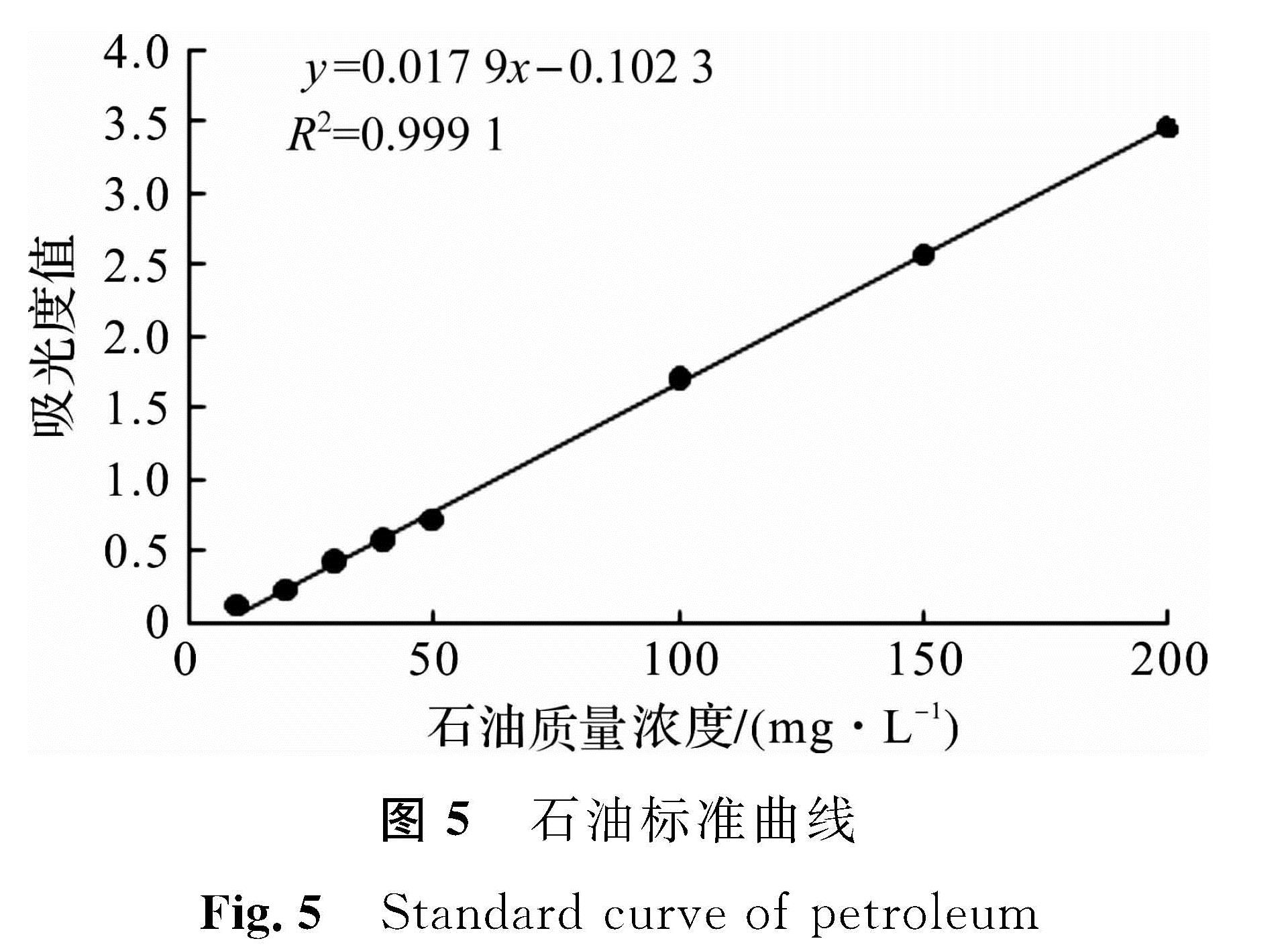
2.3 石油降解菌XS -2降解性能2.3.1 最大吸收波长和标准曲线通过紫外分光光度计进行光谱扫描发现,最大吸收波峰在224 nm处,在OD224分别测定不同标准液吸光度值,标准曲线如图5所示,相关系数R2为0.999 1,表明曲线拟合度很好。
2.3.2 降解菌XS -2对石油的降解情况
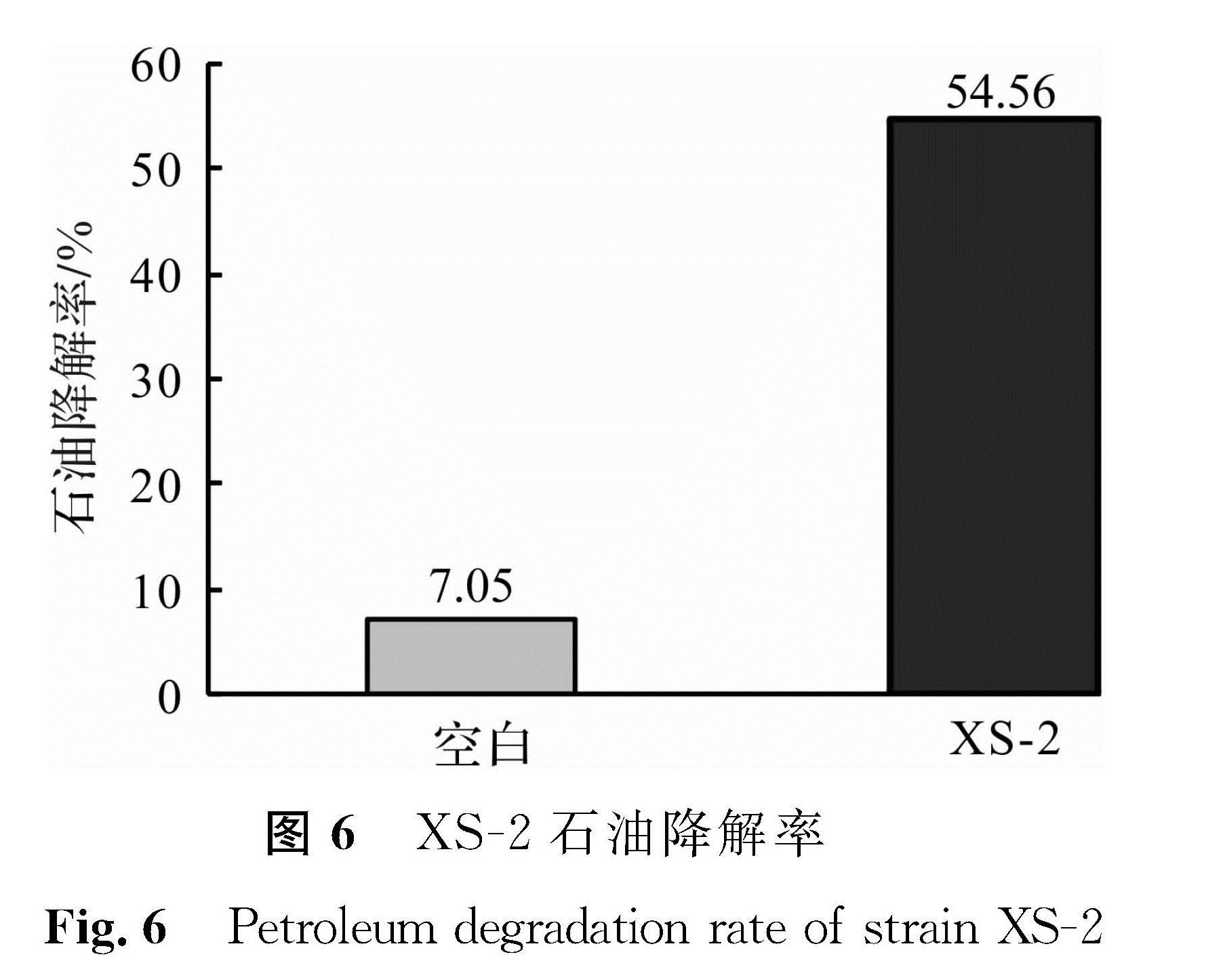
取培养16 h的XS -2菌液,按体积分数5%接种量接入LB培养基,30 ℃、200 r/min培养,在前期表现出很好的降解作用,并且与对照组相比(图6),XS -2试验组锥形瓶瓶壁上没有明显的油膜。通过紫外分光光度法测得XS -2对石油的7 d降解率达到54.56%以上,因此可以作为石油污染生物修复的降解菌株。
2.3.3 GC分析如图7所示,菌株XS -2降解的石油组分在保留时间为12.80、13.91、14.21、16.79、43.12 min的波峰均出现空白缺失,这说明菌株XS -2对碳数为14、15、16和17的正构烷烃有很好的降解效果; 保留时间为43.12 min的波峰缺失,但是多出保留时
间为40.29 min峰面积相似的波峰,这可能是菌株XS -2将保留时间为43.12 min的物质进行了降解,具体机理有待进一步试验验证。
2.4 石油降解菌XS -2降解条件优化2.4.1 培养温度对菌株XS -2石油降解性能的影响
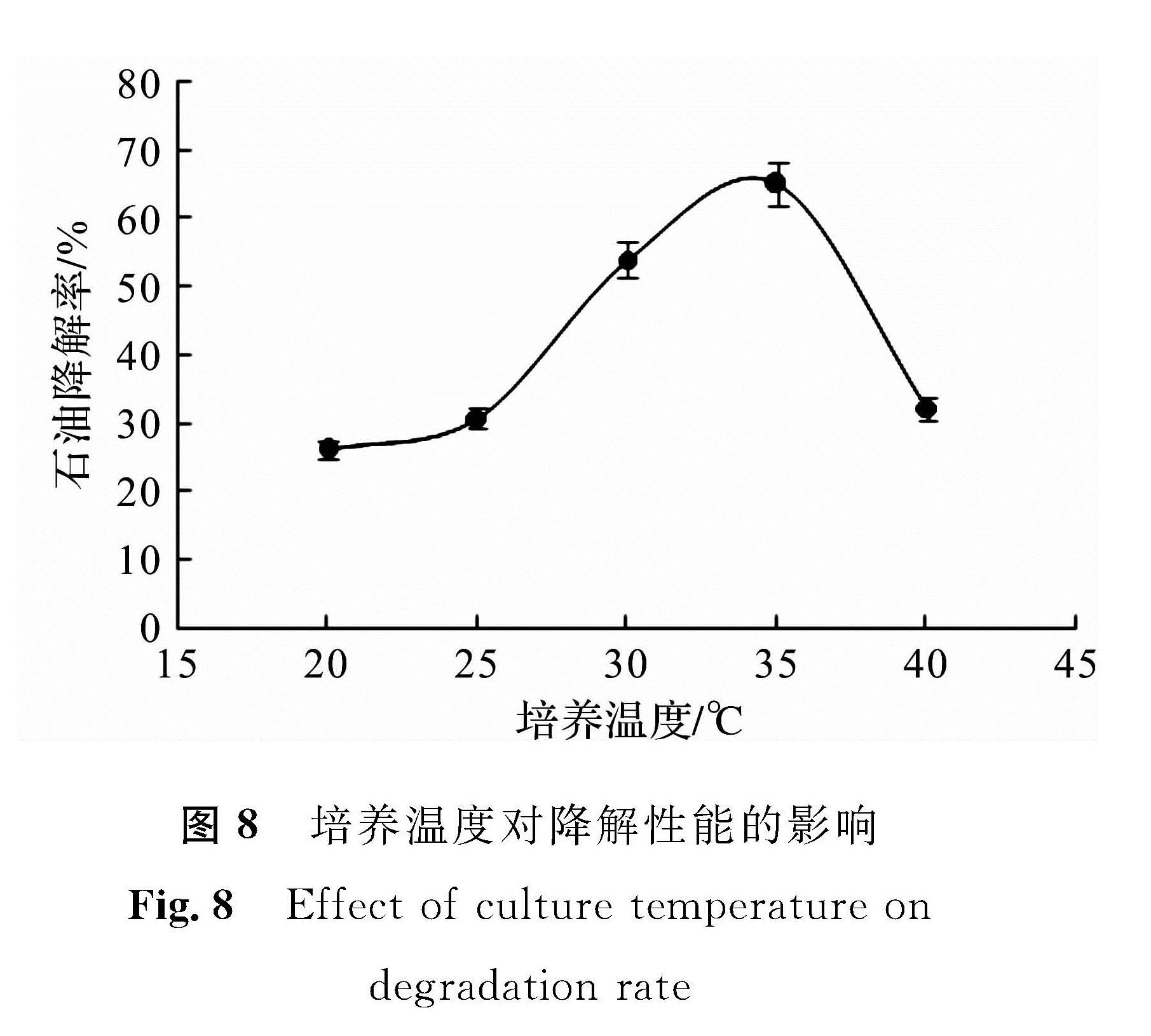
培养温度与微生物的生长繁殖、代谢活性有密切关系[12-14]。如图8所示,20~25 ℃,第7天石油降解率为30%~40%,降解率相对较低。其原因是温度较低时,细菌代谢能力受到限制,导致其代谢产物活性较低,对石油降解性能不高。随着培养温度的升高,石油降解效率显著提高,在35 ℃时达到最大值,降解率为65.13%; 之后随着温度的升高降解效果明显呈下降趋势。
在35 ℃时降解效率最高,这与菌株最佳培养温度不完全一致,其原因是微生物对石油烃的降解,主要借助酶的催化作用,如环烷烃一般先被各种氧化酶氧化为醇,然后通过脱氢酶转化为酮,最后再被氧化为酯酶或脂肪酸,而酶的活性只有在一定温度范围内才能得以发挥[15],
所以石油降解温度与菌株XS -2的最适培养温度略有差异。
2.4.2 培养基初始pH对菌株XS -2石油降解性能的影响pH过高或过低对微生物生长代谢都是不利的。如图9所示,pH值在5.0~7.0之间,菌株XS -2在第7天对石油的降解率呈上升趋势。在pH值为7.0时降解率最高达60%; 之后,随着pH升高,石油降解率明显下降。这与申圆圆的研究结果一致[16]。初始pH可以影响微生物细胞内的酶活性,进而影响其生物化学过程。因此,菌株XS -2降解石油的最佳pH值为7.0。
2.4.3 石油质量浓度对菌株XS -2石油降解性能的影响石油作为微生物生长代谢底物,其质量浓度的高低对
微生物降解性能有一定的影响。
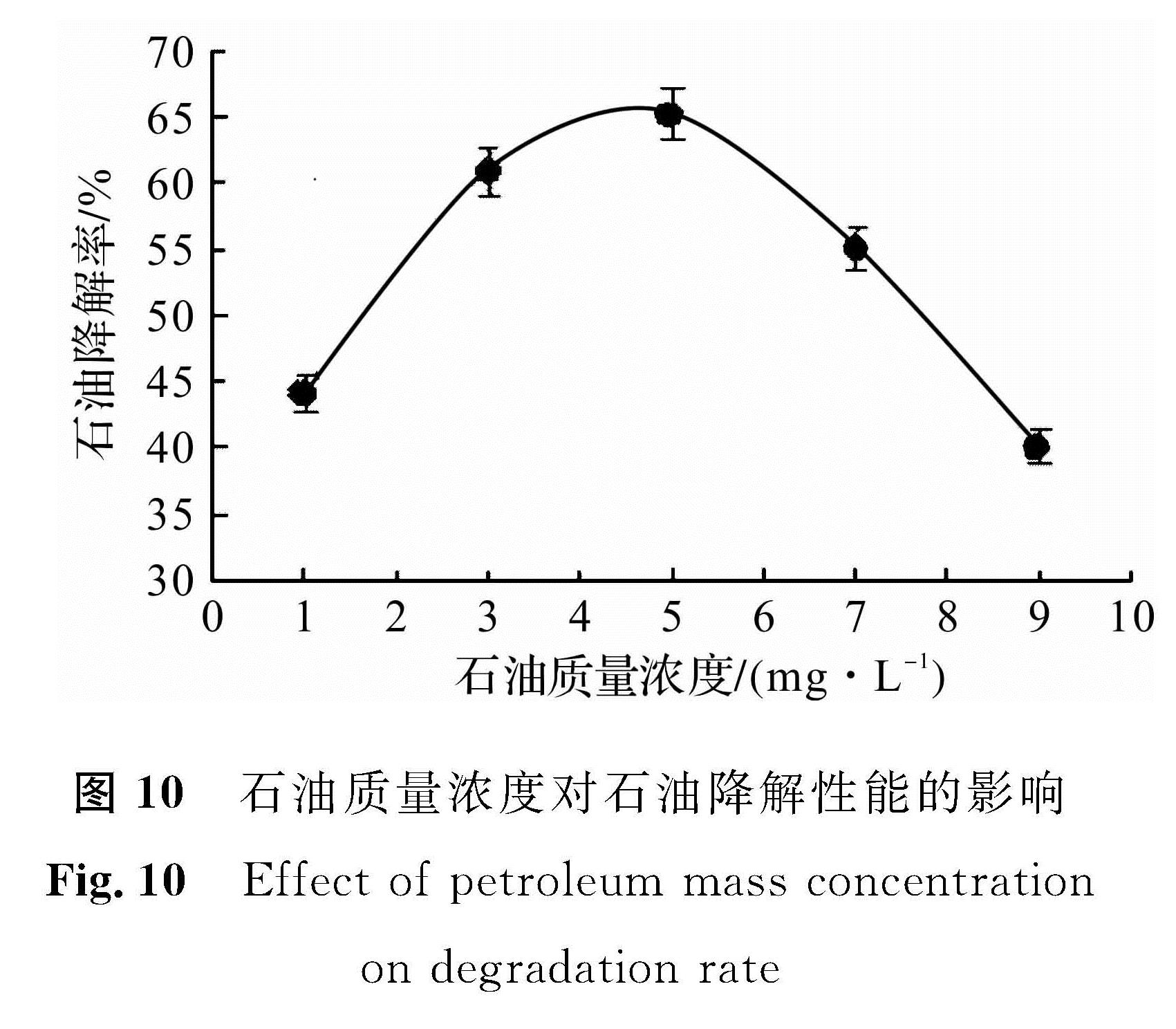
由图 10可知,随着石油质量浓度的升高,菌株XS -2对石油降解率呈先上升后下降的趋势,当石油质量浓度为5 g/L时,第7天降解率最高为65%。
石油质量浓度较低时,菌株生长底物不足,导致细菌生长缓慢,石油降解率较低,该现象与朱杰等[1]的研究结果一致。随着石油质量浓度增加,底物充足,菌株生长代谢能力旺盛,其降解率也随之提高。但并不是石油质量浓度越高越好,当石油质量质量浓度过高时,底物碳氮比失调,菌株生长受到抑制,进而使微生物对石油降解的效果显著下降。
3 结 语微生物修复无残毒、低成本、见效快,成为解决石油污染的有效途径。本试验从石油污染的土壤样品中分离到高效石油降解菌XS -2,以石油作为唯一碳源,能有效快速地清除瓶壁上的油污,使得培养基中的石油形成油水混合物,这说明它能够快速将大分子的石油烃降解,在石油污染领域开展生物修复有较高的研究价值和较好的应用前景。经菌体及菌落形态、生理生化特性和16S rRNA基因序列同源性分析,鉴定菌株XS -2为赤红球菌。
微生物作为环境修复的主体,其降解效率决定修复水平[17]。因此分别对菌株XS -2的培养温度、培养初始pH和石油质量浓度进行优化,确定在培养温度30 ℃、初始培养pH值7.0、石油质量浓度5 g/L时,赤红球菌XS -2对石油的降解率最高达到65%。经GC分析,该菌可有效降解碳原子数量为14、15、16、17的烷烃。赤红球菌XS -2对石油的降解机理以及具体效果还有待进一步深入研究。
- [1] 朱杰,阮志勇,董卫卫,等.一株高效烷烃降解菌Acinetobacter sp. LAM1007的分离鉴定及降解特性[J].微生物学通报,2017,44(7):1535.
- [2] 吴蔓莉,张晨,祁燕云,等.生物修复对黄土壤中石油烃的去除作用及影响因素[J].农业环境科学学报,2018,37(6):1159.
- [3] 李胜勇,邓伟,张大海,等.渤海及邻近海域表层沉积物中烃类物质的分布特征及其指示意义[J].海洋环境科学,2017,36(4):501.
- [4] 王婧.石油降解菌的筛选及降解特性研究[D].大连:大连工业大学,2017.
- [5] 宜慧,常波,杨玲引,等.高效石油烃降解菌的筛选及其对原油污染土壤的修复[J].化工环保,2018,38(4):461.
- [6] LIU B, JU M, LIU J, et al. Isolation, identification, and crude oil degradation characteristics of a high-temperature, hydrocarbon-degrading strain[J]. Marine Pollution Bulletin, 2016, 106(1/2):301.
- [7] DOS SANTOS J J, MARANHO L T. Rhizospheric microorganisms as a solution for the recovery of soils contaminated by petroleum: a review[J]. Journal of Environmental Management,2018,210:104.
- [8] 周德庆,徐德强.微生物学试验教程[M].3版.北京:高等教育出版社,2013:3-11.
- [9] 东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001:13-19.
- [10] 管芜萌.长庆油田石油污染土壤的原位修复微生物的筛选和鉴定[D].西安:西北农林科技大学,2010.
- [11] 孙磊,宋彤彤,朱珍妮,等.可降解三乙胺的赤红球菌S6-2的筛选与鉴定及降解特性[J].环境科学研究,2016,29(12):1884.
- [12] FATHEPURE B Z. Recent studies in microbial degradation of petroleum hydrocarbons in hypersaline environments[J]. Frontiers in Microbiology,2014,5:176.
- [13] TAJIK H, FARHANGFAR A, MORADI M, et al. Effectiveness of clove essential oil and grape seed extract combination on microbial and lipid oxidation characteristics of raw buffalo patty during storage at abuse refrigeration temperature[J]. Journal of Food Processing and Preservation,2014,38(1):31.
- [14] AYOTAMUNO M J, KOGBARA R B, OGAJI S, et al. Bioremediation of a crude-oil polluted agricultural-soil at Port Harcourt, Nigeria[J]. Applied Energy,2006,83(11):1249.
- [15] 刘秋,张耀尹,曹雪洁,等.海洋石油降解微生物及其降解机理[J].微生物学杂志,2016,36(3):3.
- [16] 申圆圆.土壤中石油污染物行为特征及植物根际修复研究[D].西安:长安大学,2012.
- [17] FULEKAR M H. Microbial degradation of petrochemical waste-polycyclic aromatic hydrocarbons[J]. Bioresources and Bioprocessing,2017,4:28.
 图 1 菌株XS -2对石油的降解作用
Fig.1 Petroleum degradation by strain XS -2
图 1 菌株XS -2对石油的降解作用
Fig.1 Petroleum degradation by strain XS -2