为了体外固定化不稳定单链拓扑DNA,采用阴阳离子共聚法制备壳聚糖/拓扑DNA复合纳米粒子,并进行傅立叶变换红外光谱、粒径/zeta电位和透射电子显微镜等分析表征。结果 显示,纳米粒子中DNA上磷酸基团振动峰显著减弱,高温制备样品中双链DNA含量少于低温样品,表明DNA的不稳定单链结构获得了体外固定化; 同时,伴随DNA单链比例升高,复合纳米粒子的平均水合粒径由573.9 nm降到205 nm,zeta电位由19.53 mV降到9.75 mV,复合纳米粒子结构由核壳结构转变为实心胶束结构。几种差异结构壳聚糖/DNA纳米粒子的成功制备,可为后续生物活性或载药研究提供良好的技术支持。
In order to immobilize unstable single-stranded DNA, an anionic-cationic co-assembly method was applied for preparation of chitosan/DNA composite nanoparticles. The chemical and physical properties of composite nanoparticles were characterized by Fourier transform infrared spectroscopy, size distribution/zeta potential and transmission electron microscope. The results indicate that vibration peak of phosphate group on DNA gets weakened remarkably after DNA is coated in chitosan nanoparticles. The content of double-stranded DNA in nanoparticles prepared at high temperature is lower than that in the sample prepared at low temperature. These results show that single-stranded DNA has been immobilized in composite nanoparticles. At the same time, along with the increase of single-stranded DNA percentage, average hydrated particle sizes and zeta potentials of composite nanoparticles decrease from 573.9 nm to 205 nm and from 19.53 mV to 9.75 mV, respectively, coupled with structure transfer of composite nanoparticles from core shell to solid micelle. Successful preparation of several chitosan/DNA nanoparticles with different structures can provide sound technical support for subsequent research on biological activity or drug loading.
脱氧核糖核酸(deoxyribonucleic acid,DNA)是生物遗传信息的携带者,同时也是一种功能多样的生物高分子。双链DNA(dsDNA)的解链构象-单链DNA(ssDNA),既是基因编辑的重要靶标物[1],也是DNA材料研究的常见原料[2]。ssDNA在体外常温下倾向于互补配对形成部分双链结构,这对常温下研究ssDNA生物学活性和操作ssDNA材料造成了阻碍。已知dsDNA在受热情况下,能够解链形成并保持ssDNA结构。如能将高温下的ssDNA结构固定化,则将为常温下研究ssDNA的生物学功能和ssDNA基功能材料研发提供有益参考。
壳聚糖(chitosan,CS)是天然阳性多糖,已被大量研究证实为优良的核酸载体。已见报道的CS/DNA复合物大致可以分为4类:1)非靶向CS/DNA纳米粒子,如CS/超螺旋DNA和CS/dsDNA/siRNA复合纳米粒子[3]、改性CS/超螺旋DNA纳米粒子[4]等,均表现出良好的哺乳细胞转染功能; 2)靶向CS/DNA复合纳米粒子,如靶向大脑的锰福地吡-CS/siRNA/DNA纳米粒子[5]、靶向肿瘤细胞的CS纳米粒子[6]等; 3)智能响应CS/DNA复合纳米粒子,如ATP响应[7]、氧化还原响应[8]、磁场响应CS纳米转染制剂[9]等; 4)CS/DNA基人工模拟物,如CS/DNA基人工模拟酶,表现出高催化活性和高抗逆性[10]。相比种类繁多的CS/核酸复合纳米粒子报道,关于CS与核酸相互作用机制及其对细胞侵染效率的影响报道相对较少。现有研究表明,CS与DNA间弱相互作用力有利于对哺乳细胞的转染[11],CS上氨基与DNA上磷酸基团的比例对转染效率存在显著影响[12],具有支化结构的CS较线型CS具有更好的基因递送效果和更佳的细胞相容性[13]等。这些研究虽对CS/DNA相互作用与其基因转染效果间关系进行了探索性研究,但对分子水平的相互作用机制研究报道仍较少。石幻君等[14]发现磺化壳聚糖铁配合物可通过嵌插作用来解链dsDNA。Shen等[15]通过动态分子模拟发现,DNA上带负电磷酸基团与CS上带正电氨基之间的互作是壳聚糖负载DNA的主要机制。
综合以上研究可以发现,正电性CS与负电性DNA间的静电自组装是CS包埋DNA的主要作用机制。如能在体外制备携带单链区段的DNA,并在保持ssDNA构象条件下引发壳聚糖与DNA间的共聚,则有可能实现不稳定ssDNA拓扑构象的固定化。因此,我们采用热处理的方法,制备携带单链区段的线型DNA,并与CS共聚形成复合纳米粒子,对不稳定ssDNA在复合纳米粒子中的固定化负载效果进行分析评价。
1 材料与方法1.1 试验材料壳聚糖(粘均相对分子质量150 kDa,脱乙酰度90%以上),国药集团化学试剂有限公司; 鲑鱼精DNA(D1626),美国Sigma-Aldrich公司,其0.25 mg/mL水溶液A260/A280=1.92,A260/A230=2.35; SYBR Green Ⅰ荧光染料,美国MP Biomedicals公司; 其他常规生化试剂均为国产分析纯。
1.2 dsDNA热处理及解链度测定将鲑鱼精DNA溶解于超纯水中,配置质量浓度为55 ng/μL的DNA溶液。取DNA溶液0.5 mL与SYBR Green Ⅰ原液(*10 000母液)0.5 μL混合均匀,于37 ℃下避光孵育1 h。将经过孵育的DNA溶液分装于20个0.2 mL平盖PCR管中,在荧光定量PCR仪CFX96上,分别于25、60、90 ℃下测量SYBR Green Ⅰ的绿色荧光信号强度。以25 ℃下测得荧光信号值为100% dsDNA荧光信号值,将60 ℃和90 ℃下荧光信号值与25 ℃荧光信号值相除,计算各温度下dsDNA的百分比含量。
1.3 携带单链区段DNA在壳聚糖复合纳米粒子中的负载将CS溶解于1%醋酸溶液中,并以NaOH溶液调节pH值,配制质量浓度为1 mg/mL,pH值为5.5的CS溶液。将鲑鱼精DNA溶解于超纯水中,质量浓度为0.25 mg/mL。
在25 ℃下,按CS与DNA质量比为4/1、1/1和1/2,将DNA溶液在磁力搅拌下滴加到CS溶液中。在60、90 ℃下,按CS与DNA质量比为4/1,将DNA溶液在磁力搅拌下滴加到CS溶液中。DNA滴加溶液逐渐呈现蓝白色荧光(后续检测表明CS与DNA共聚形成了复合纳米粒子)。
1.4 复合纳米粒子表征傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)分析采用傅里叶变换红外光谱仪Paragon 1000型(美国Perkin Elmer公司),在500~4 000 cm-1范围内扫描,样品与KBr粉末混合后压成薄片测定; 差示扫描量热分(differential scanning calorimetry,DSC)分析采用差示扫描量热仪DSC Q100 V9.9 Build 303型(美国TA Instruments公司),冷冻干燥样品质量为3~5 mg,先将样品从室温降到-40 ℃,保持3 min,然后以20 ℃/min升温到250 ℃; 粒径分布和zeta电位分析采用Zetasizer 3000HS型(美国马尔文仪器有限公司),以纳米溶液直接测定; 透射电子显微镜观察(transmission electron microscope,TEM)采用JEM-1200EX型号(日本JEOL公司),制样方法为悬滴法。
2 结果与讨论2.1 不同温度处理下DNA的解链度SYBR Green Ⅰ能够与dsDNA的小沟结合,结合后的荧光信号可增强800~1 000倍。在25 ℃下,dsDNA结构稳定,SYBR Green Ⅰ与DNA充分结合,在蓝光(497 nm)激发下发射绿色荧光信号(520 nm)。当温度升高到60 ℃和90 ℃时,dsDNA部分解链产生ssDNA区段。在ssDNA区段上,DNA小沟消失,SYBR Green Ⅰ从相关位点脱落,520 nm下荧光信号减弱。同时,未解链dsDNA区段SYBR Green Ⅰ仍结合于DNA小沟上,荧光信号得到保持。将60 ℃和90 ℃下荧光信号值分别与25 ℃下荧光信号值相除即可计算相应处理温度下的dsDNA的百分比含量,并推算出相应的ssDNA百分比含量。结果显示,在60、90 ℃下dsDNA的百分比含量分别为66.9%±;1.8%、10.5%±;1.3%,ssDNA百分比含量分别为33.1%±;1.5%、89.5%±;1.9%。表明在25、60、90 ℃处理下,获得了具有不同解链度的DNA样品。60、90 ℃处理下产生的ssDNA在温度降低后会重新形成链内或链间dsDNA结构,表现为不稳定拓扑结构。
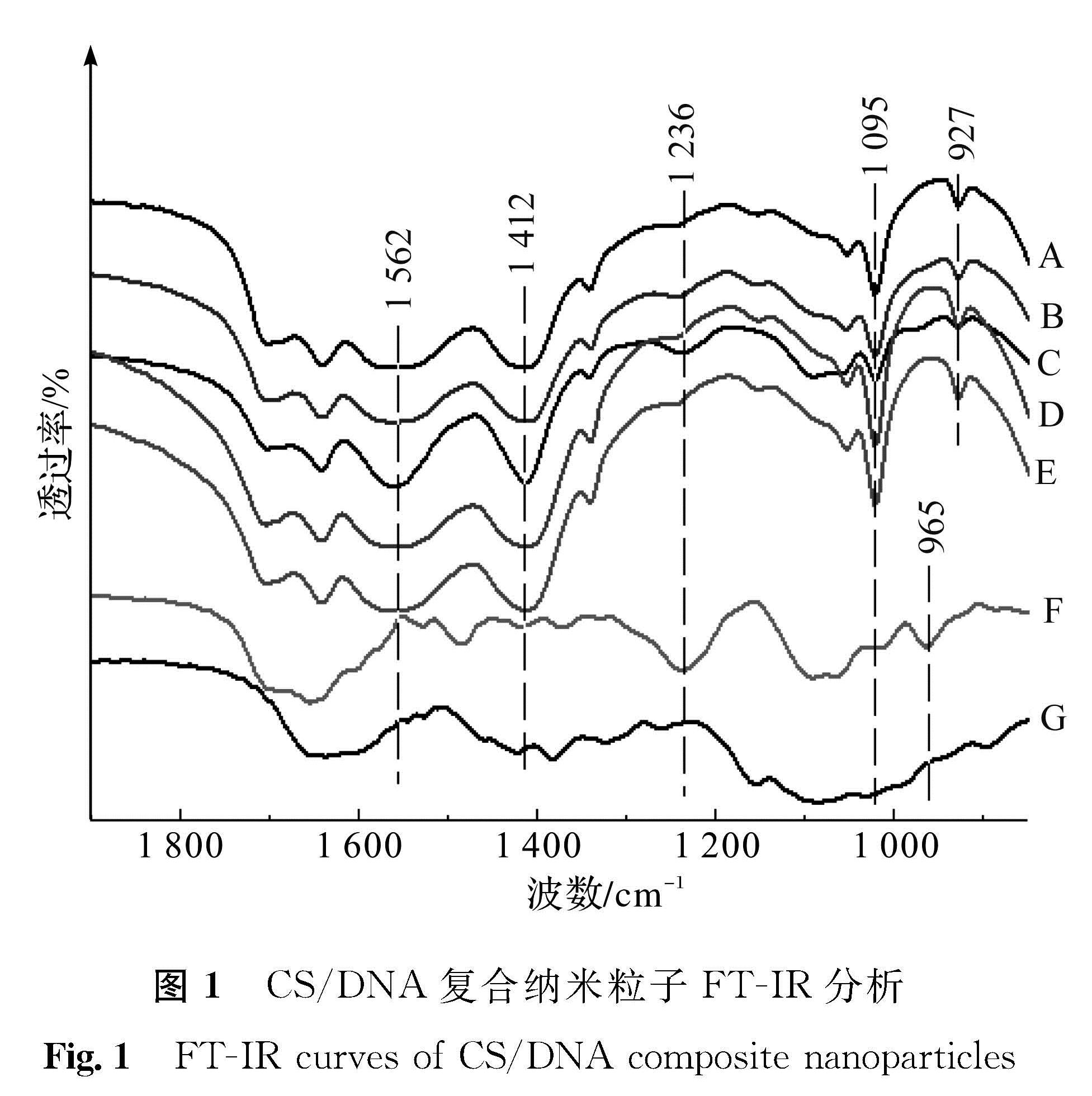
2.2 复合纳米粒子的FT-IR分析
CS/DNA复合纳米粒子FT-IR分析结果如图1所示,A、B、C对应样品为25 ℃下DNA与CS质量比分别为4/1、1/1、1/2时制备纳米粒子; D、E对应样品为DNA与CS质量比为4/1时,分别在60、90 ℃下制备纳米粒子; F为DNA,G为CS。从图1可知,DNA在1 236 cm-1和1 095 cm-1处吸收峰分别为磷酸基团(PO21-)反对称伸缩振动和对称伸缩振动峰[16-17],在CS包埋DNA形成的复合纳米粒子中,当CS与DNA比例(CS/DNA)为4/1或1/1时,上述两处吸收峰微弱。在CS/DNA为1/2样品中,上述两处吸收峰强度高于4/1或1/1样品。这表明,在4/1或1/1的CS/DNA比例下,DNA上的磷酸基团被充分固定化,对称振动减弱; 而在1/2比例下,较多磷酸基团保留了对称振动状态。磷酸基团是DNA骨架的主要结构基团,CS/DNA复合纳米粒子中DNA磷酸基团的固定化,意味着DNA结构的固定化。Shen等[15]的CS负载DNA分子动态分子模拟研究报道,同样认为DNA上带负电磷酸基团与CS上带正电氨基之间的相互作用是壳聚糖负载DNA的主要机制。此外,DNA在1 236 cm-1处吸收峰是B -DNA特征峰[18],在CS/DNA复合纳米粒子中,该处吸收峰的减弱表明CS可能与其他多胺类高分子一样,能够诱导天然右手螺旋B -DNA转变为左手螺旋Z -DNA[19]。DNA在965 cm-1处的吸收峰为其主链核糖振动吸收峰,在复合纳米粒子中该振动峰向低波数方向移动到了927 cm-1,也表明复合纳米粒子中的DNA结构得到了固定化。对于复合纳米粒子中DNA解链度问题,由于DNA与CS之间及DNA碱基对之间存在多种氢键作用力且氢键构成基团相似,因此无法从傅立叶变换红外光谱中有效解析获得DNA的解链度信息。
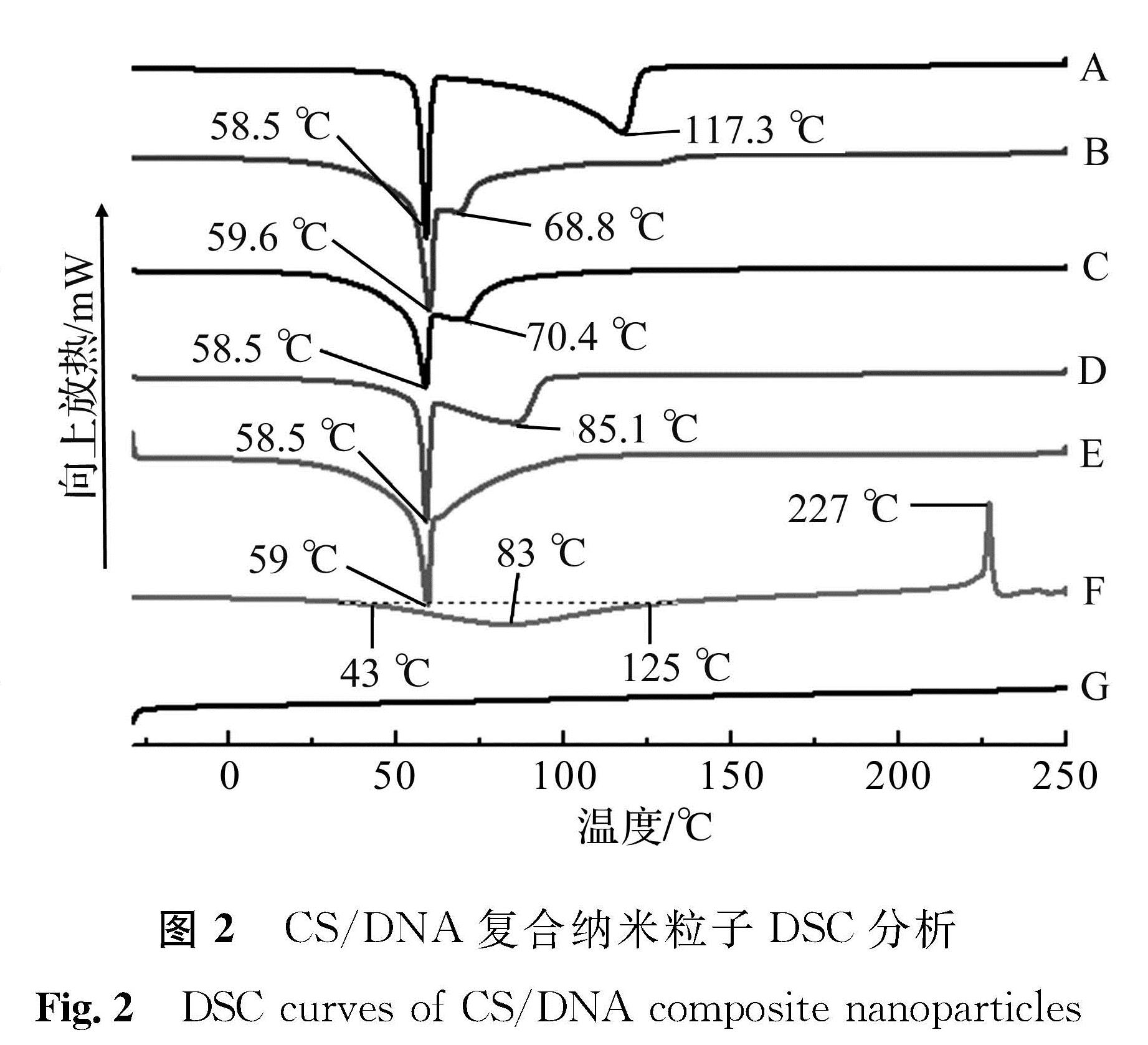
2.3 复合纳米粒子DSC分析
CS/DNA复合纳米粒子DSC分析结果如图2所示,A、B、C、D、E、F、G对应样品与图1同。由图2可知,天然鲑鱼精DNA在43~125 ℃出现较平缓吸热单峰,峰值温度为83 ℃,该峰为dsDNA解链形成ssDNA过程吸热所致。在227 ℃附近出现的放热峰则为DNA氧化分解放热所致。CS在-30~250 ℃未出现明显吸放热峰。相比天然鲑鱼精DNA,CS/DNA复合纳米粒子的峰形和数量发生了显著变化:首先,5个CS/DNA复合纳米粒子样品(A、B、C、D和E)均在59 ℃附近出现第1个吸热峰,该峰为dsDNA局部解链DNA呼吸增强所致; 其次,25 ℃或60 ℃下制备的4个CS/DNA复合纳米粒子样品(A、B、C和D),均在68.8~117.3 ℃间出现了第2个吸热峰,该峰为dsDNA完全解链吸热所致; 最后,227 ℃附近未见DNA氧化分解放热峰出现,表明经CS包埋保护后dsDNA的分解温度得到了提高。比较样品A、B和C可以看出,当CS/DNA为4/1时,DNA完全解链温度最高,为117.3 ℃。这一升高DNA完全解链温度与较高CS/DNA比例下(4/1),过量CS与DNA饱和相互作用导致DNA热稳定性提高有关[20],同时也表明CS/DNA为4/1下,DNA与CS相互作用饱和度较高,有利于DNA拓扑结构的固定化。进一步比较样品A、D和E可以看出,相同CS/DNA比例下,制备温度分别为25、60、90 ℃时,DNA完全解链吸热峰逐渐向低温方向移动。由于在DNA序列相同的情况下,DNA的解链温度与其双链区段长度呈正相关,因此制备温度从25 ℃升到90 ℃过程中,CS/DNA复合纳米粒子中,dsDNA区段呈逐渐缩短趋势,相应ssDNA区段呈增长趋势。这表明,在60、90 ℃下产生的携带单链区段的DNA拓扑结构,在复合纳米粒子中得到了固定化。
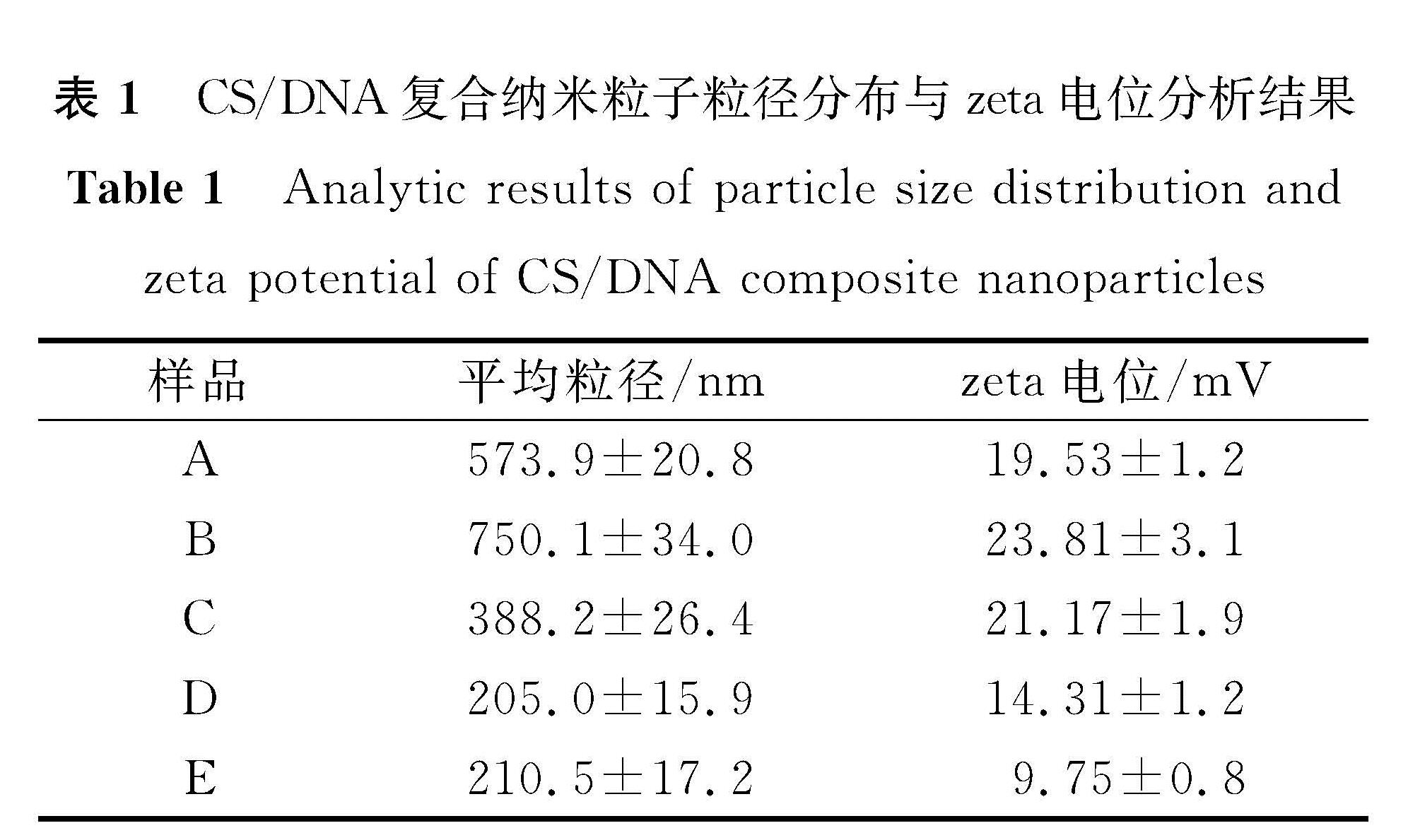
2.4 复合纳米粒子的粒径分布与zeta电位
表1 CS/DNA复合纳米粒子粒径分布与zeta电位分析结果
Table 1 Analytic results of particle size distribution and zeta potential of CS/DNA composite nanoparticles
CS/DNA复合纳米粒子粒径分布与zeta电位分析结果见表1,A、B、C、D、E对应样品与图1同。由表1可知,当制备温度为25 ℃时,伴随CS/DNA比例降低,复合纳米粒子平均粒径和zeta电位均出现先升高后降低的变化; 当CS/DNA比例固定为4/1时,伴随制备温度升高,复合纳米粒子平均粒径和zeta电位均呈降低趋势。制备温度为25 ℃时,不同CS/DNA比例导致的平均粒径和zeta电位差异,可能与CS和DNA聚集程度不同有关。当CS/DNA比例均为4/1时,不同制备温度下(25、60、90 ℃)出现的粒径和zeta电位差异,应与DNA的解链度不同有关。在25 ℃下,天然鲑鱼精DNA主要以双链形式存在,分子刚性较强,与CS共聚形成较大纳米颗粒(平均水合粒径573.9 nm); 在60、90 ℃下,鲑鱼精DNA发生解链,以双链/单链双重结构形式存在,分子刚性减弱,容易与CS共聚缠绕形成较小纳米颗粒(平均水合粒径分别为205、210.5 nm)。而伴随制备温度升高,zeta电位逐渐降低(由19.53 mV降到9.75 mV),可能是较高制备温度下含量较高ssDNA的存在降低了DNA与CS的聚集度,导致了复合纳米粒子内正电性CS比例的降低。
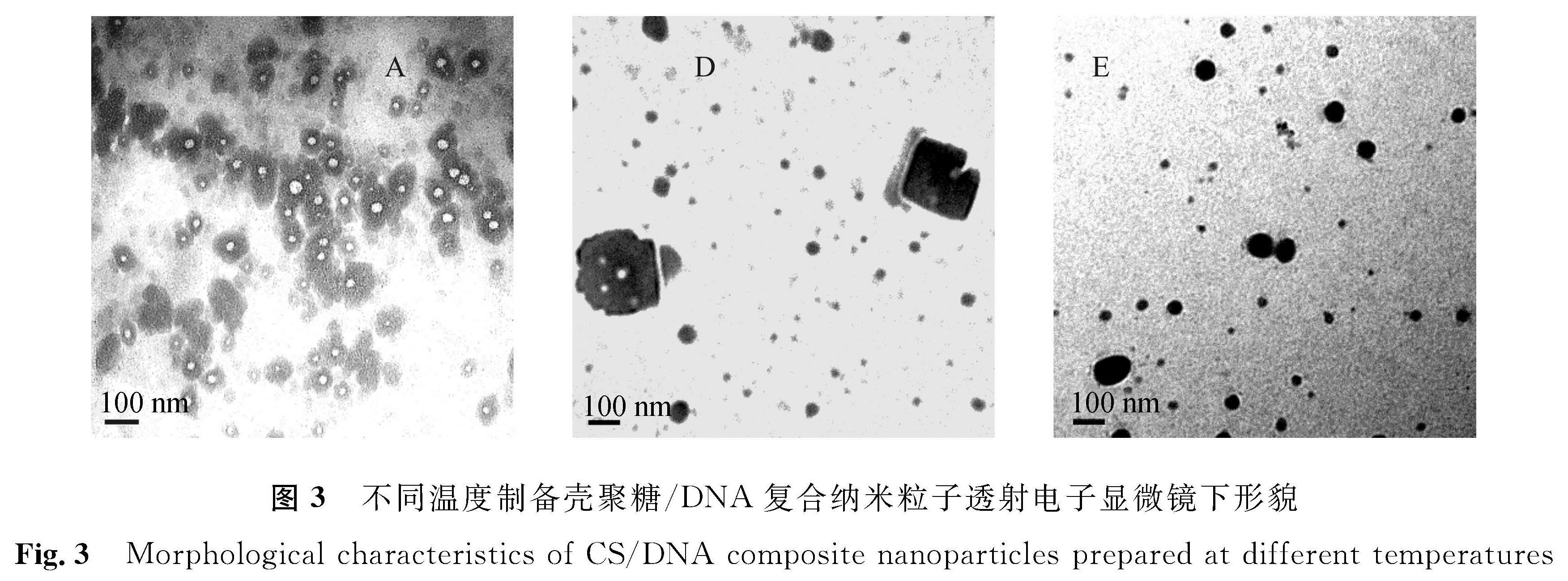
2.5 TEM分析对CS/DNA比例均为4/1,制备温度分别为25、60、90 ℃的样品A、D、E进行了TEM观测,结果见图3。从图3可以看出,3个制备温度下复合纳米粒子形貌差异显著。在25 ℃下制备样品(A),复合纳米颗粒粒径较大,存在大量粒径大于100 nm的复合纳米颗粒,且颗粒中部多存在低电子密度区域,应为电子密度较低的DNA集中分布区域。在60 ℃下制备样品(D),粒径大于100 nm的复合颗粒减少,粒径小于100 nm的复合颗粒显著增多,颗粒中低电子密度区域明显减少。在90 ℃下制备样品(E),仍存在部分粒径大于100 nm的复合颗粒,但以粒径小于100 nm的复合颗粒为主,颗粒内部低电子密度区域消失。由于A、D、E样品间的主要差别是制备温度不同,即DNA解链度不同,因此3个样品间复合纳米颗粒结构差异主要由构成复合纳米颗粒的DNA拓扑结构差异造成。同时也反映出,在3个制备温度下,携带不同比例ssDNA区段的稳定或不稳定DNA拓扑结构均被固定化负载到了复合纳米颗粒中。
图3 不同温度制备壳聚糖/DNA复合纳米粒子透射电子显微镜下形貌
Fig.3 Morphological characteristics of CS/DNA composite nanoparticles prepared at different temperatures
3 结 语
通过差异加热处理,制备了携带不同比例ssDNA区段的拓扑结构稳定或不稳定的DNA,并在相应温度下制备了CS/DNA复合纳米粒子,使得DNA的拓扑结构在复合纳米粒子中得到了固定化。尤其在CS/DNA为4/1情况下,FT-IR测试中DNA主链上磷酸基团和糖链振动均出现减弱; DSC测试中第二吸热峰伴随制备温度升高向低温方向迁移的行为,也与热处理导致的DNA双链区段长度变化预期相符; 粒径分布、zeta电位和TEM测试等进一步反映出负载不同拓扑结构DNA的纳米粒子,在形貌和结构特征上存在显著差异。这些结果均有力地证明,携带单链区段的拓扑结构DNA在复合纳米粒子中获得了良好的固定化。
- [1] APARICIO T, DE LORENZO V, MARTíNEZ-GARCíA E. CRISPR/Cas9-enhanced ssDNA recombineering for Pseudomonas putida[J].Microbial Biotechnology,2019,12(5):1076.
- [2] JULIN S, KORPI A, NONAPPA N, et al. DNA origami directed 3D nanoparticle superlattice via electrostatic assembly[J].Nanoscale,2019,11(10):4546.
- [3] PENG S F, YANG M J, SU C J, et al. Effects of incorporation of poly(γ-glutamic acid)in chitosan/DNA complex nanoparticles on cellular uptake and transfection efficiency[J].Biomaterials,2009,30(9):1797.
- [4] RAMESAN R, SHARMA C P. Modification of chitosan nanoparticles for improved gene delivery[J].Nanomedicine,2012,7(1):5.
- [5] SANCHEZ-RAMOS J, SONG S J, KONG X Y, et al. Chitosan-mangafodipir nanoparticles designed for intranasal delivery of siRNA and DNA to brain[J].Journal of Drug Delivery Science and Technology,2018(43):453.
- [6] 孙平.H6R6短肽修饰的壳聚糖纳米粒用于siRNA的递送及其在肿瘤治疗中的应用[D].北京:北京协和医学院,2017.
- [7] ZHAO M H, ZHANG Y, YUAN S R, et al. ATP responsive DNA nanogels grown on biocompatible branches for anticancer drug delivery[J].Soft Matter,2019,15(18):3655.
- [8] LIN J T, LIU Z K, ZHU Q L, et al. Redox-responsive nanocarriers for drug and gene co-delivery based on chitosan derivatives modified mesoporous silica nanoparticles[J].Colloids and Surfaces B: Biointerfaces,2017,155:41.
- [9] SOHRABIJAM Z, SAEIDIFAR M, ZAMANIAN A. Enhancement of magnetofection efficiency using chitosan coated superparamagnetic iron oxide nanoparticles and calf thymus DNA[J].Colloids and Surfaces B: Biointerfaces,2017,152:169.
- [10] WANG Z G, LI Y Z, WANG H, et al. Enzyme mimic basing on self-assembled chitosan/DNA hybrid exhibits superior activity and tolerance[J].Chemistry,2019,25(54):12576.
- [11] ALATORRE-MEDA M, TABOADA P, HARTL F, et al. The influence of chitosan valence on the complexation and transfection of DNA: the weaker the DNA-chitosan binding the higher the transfection efficiency[J]. Colloids and Surfaces B: Biointerfaces,2011,82(1):54.
- [12] ALAMEH M, LAVERTU M, TRAN-KHANH N, et al. SiRNA delivery with chitosan: influence of chitosan molecular weight, degree of deacetylation, and amine to phosphate ratio on in vitro silencing efficiency, hemocompatibility, biodistribution, and in vivo efficacy[J].Biomacromolecules,2018,19(1):112.
- [13] MALMO J, VARUM K M, STRAND S. Effect of chitosan chain architecture on gene delivery: comparison of self-branched and linear chitosans[J].Biomacromolecules,2011,12(3):721.
- [14] 石幻君,程进征,王学东,等.磺化壳聚糖铁配合物的制备及其与DNA相互作用研究[C]//中国化学会第八届全国配位化学会议.大连:中国化学会,2017:1.
- [15] SHEN J W, LI J C, ZHAO Z N, et al. Molecular dynamics study on the mechanism of polynucleotide encapsulation by chitosan[J].Scientific Reports,2017,7(1):1.
- [16] LIU W G, SUN S J, CAO Z Q, et al. An investigation on the physicochemical properties of chitosan/DNA polyelectrolyte complexes[J].Biomaterials,2005,26(15):2705.
- [17] MADY M, AWADW W, EI-GUENDY N, et al. Interaction of DNA and polyethylenimine: Fourier-tranform infrared(FTIR)and differential scanning calorimetry(DSC)studies[J].International Journal of Physical Sciences,2011,6(32):7328.
- [18] DOVBESHKO G, GRIDINA N Y, KRUGLOVA E B, et al. FTIR spectroscopy studies of nucleic acid damage[J].Talanta,2000,53(1):233.
- [19] HACKL E V, KORNILOVA S V, BLAGIO Y P. DNA structural transitions induced by divalent metal ions in aqueous solution[J].International Journal of Biological Macromolecules,2005,35(3/4):175.
- [20] EXPOSITO D, VECCHIO P D, BARONE G. Interactions with natural polyamines and thermal stability of DNA: a DSC study and a theoretical reconsideration[J].Journal of the American Chemical Society,1997,119(11):2606.
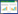 图 1 CS/DNA复合纳米粒子FT-IR分析
Fig.1 FT-IR curves of CS/DNA composite nanoparticles
图 1 CS/DNA复合纳米粒子FT-IR分析
Fig.1 FT-IR curves of CS/DNA composite nanoparticles