激肽释放酶相关蛋白酶(kallikrein-related peptidases,KLKs)是一类丝氨酸蛋白酶,代表胰蛋白酶活性和胰凝乳蛋白酶活性的一个最大的蛋白酶家族[1]。KLKs由颗粒层中的角质形成细胞而产生,然后释放到颗粒层和角质层的间隙中[2]。Pampalakis等[3]发现在健康皮肤中表达的KLKs至少有8种,在表皮发挥关键作用的是KLK5、KLK7、KLK8和KLK14。其中KLK5和KLK7参与角质层蛋白水解,从而作用于皮肤的脱屑过程[4]。
丝氨酸蛋白酶抑制剂(serine protease inhibitor Kazal-type,SPINKs)动态调控KLKs的活性以维护皮肤正常的屏障功能[5]。目前已发现3个对KLKs有选择性抑制作用的SPINKs成员,即SPINK5、SPINK6和SPINK9[6]。Chavanas等[7]的研究发现,SPINK5的基因突变会导致KLK5和KLK7的活性失调,从而引发内瑟顿综合征,并表现出特应性皮炎样症状。SPINK9既是KLK5的选择性抑制剂,又是一种大肠杆菌选择性抗菌肽[8,9]。SPINK6是KLKs的选择性抑制剂,主要影响人类皮肤中最重要的3种KLKs,即KLK5、KLK7和KLK14[6],是医学上重要的丝氨酸蛋白酶抑制剂。Toillon等[10]的研究发现,SPINK6在睾丸、大脑和甲状腺等各种组织和器官中均有分布,其生物活性可能不止作用在皮肤上。Lu等[11]使用真核表达系统生产SPINK6蛋白,产量达到12.5 mg/L,但由于所表达的SPINK6不带标签,对后续的纯化过程造成一定的困难,而且胞外表达的hSPINK6易被降解[12]。
综上所述,SPINK6蛋白具有重要的医学研究与应用价值。然而,由于SPINK6蛋白难以从皮肤中大量分离,其功能和分子作用机制的研究受到了限制。本研究使用大肠杆菌表达系统高效表达重组SPINK6蛋白,效率高、成本低,为进一步推进SPINK6蛋白的研究和应用提供参考。
1 材料与方法1.1 试 剂pE-SUOM3质粒和SUMO蛋白酶2均购自艾美捷科技有限公司; Trizol总RNA抽提试剂盒购自上海生工生物技术有限公司; 大肠杆菌感受态TOP10、BL21(DE3)plysS购自北京全式金生物技术有限公司; 高保真DNA聚合酶(PrimerStar HS)购自TaKaRa公司; 逆转录酶(Superscript Ⅱ RNaseH)购自德国Invitrogen公司; 限制性核酸内切酶BsaⅠ和BamHⅠ、T4 DNA连接酶购自NEB公司; 镍柱(HisTrap FF)购自GE Healthcare公司; C8柱购自德国Macherey-Nagel公司; C4柱(Jupiter-5μ-C4-300A)柱购自德国Phenomenex公司; 其余试剂为国产分析纯。
1.2 设备与仪器蛋白纯化系统(GEÄKTA Pure 25 L1),美国通用电气公司; 液相制备色谱(LC-8A),日本岛津公司; 飞行时间质谱仪(G2-XS QTof),美国沃特世公司; 台式冷冻离心机(Microfuge 20R),美国贝克曼公司; 基因扩增仪(TC-96),杭州博日科技有限公司。
1.3 方 法1.3.1 pE-SUMO3-SPINK6重组表达质粒的构建用TRIzol总RNA抽提试剂盒从人包皮培养的角质形成细胞中分离总RNA。以2 μg总RNA作为模板,逆转录获得SPINK6基因的转录本。用SPINK6特异性引物(上游引物5'-ACTCAGGAAAGCAG-3',下游引物5'-TGGCAAGTCACAAGAACA-3')进行PCR扩增,产物用质量分数为2%的琼脂糖凝胶分离并测序。将反应混合物稀释50倍,进行进一步的PCR试验,用引物(上游引物5'-AAGGTCTCAAGGTCATCACCATCATCATCACCATCACCAGGGAGGACAGGTTGACTGT-3',下游引物5'-AAGGATCCTCAATGGTGATGATGATGGTGATGATGGCATTTTCCAGGATGCTTTAG-3')进行扩增,引入BsaⅠ和BamHⅠ酶切位点,产物用质量分数为2%的琼脂糖凝胶分离。用BsaⅠ和BamHⅠ酶对聚合酶链式反应产物和pE-SUMO3质粒进行双酶切,回收酶切产物,用T4连接酶在16 ℃下连接过夜。将连接好的重组质粒转化到大肠杆菌感受态TOP10菌株中培养,扩增质粒后提取质粒测序确认。
1.3.2 pE-SUMO3-SPINK6重组融合蛋白的表达将重组质粒pE-SUMO3-SPINK6导入大肠杆菌感受态BL21(DE3)plysS中,挑选含有卡那霉素(50 mmol/L)和氯霉素(34 mmol/L)的平板上生长的阳性单菌落,接种到含有卡那霉素(50 mmol/L)和氯霉素(34 mmol/L)的LB培养基中培养。当菌体富集到一定浓度(用OD600检测)时,加入异丙基-β-D硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)诱导其表达蛋白。诱导表达结束后,将菌悬液于4 ℃,5 000 g离心5 min,收集菌体沉淀,加入蛋白酶抑制剂,超声波破碎后4 ℃,13 500 g离心45 min,保留上清液,于-80 ℃冰箱保存。
1.3.3 Ni2+-NTA亲和层析纯化取出蛋白样品,冰上化冻后用0.45 μm滤膜过滤,用镍柱进行Ni2+-NTA亲和层析。洗脱体系为流动相A(20 mmol/L磷酸钠,0.5 mol/L氯化钠,20 mol/L咪唑,pH 7.4)和流动相B(20 mmol/L磷酸钠,0.5 mol/L氯化钠,500 mol/L咪唑,pH 7.4),流速为1.0 mL/min。设置洗脱条件如下:平衡柱子5 min,0%流动相B; 进样10 min,0%流动相B; 清洗10 min,0%流动相B; 洗脱15 min,流动相B由0%升至100%; 再生5 min,100%流动相B。检测在280 nm波长处的吸光度,收集出峰位置的蛋白,于-80 ℃冰箱保存。
1.3.4 RP8-HPLC纯化对经Ni2+-NTA纯化的收集峰,调整pH值为2~3,用0.45 μm滤膜过滤。洗脱体系为流动相A(0.05%三氟乙酸(TFA))和流动相B(乙腈中加入0.05% TFA),流速为3.0 mL/min。设置洗脱条件如下:平衡柱子10 min,10%流动相B; 进样10 min,10%流动相B; 第一步洗脱25 min,流动相B由10%升至60%; 第二步洗脱5 min,流动相B由60%升至100%; 再生5 min,100%流动相B。检测在215 nm波长处的吸光度,收集出峰位置的蛋白,ESI-MS鉴定后冷冻干燥,-80 ℃冰箱保存。
1.3.5 pE-SUMO3-SPINK6重组融合蛋白的酶切用SUMO蛋白酶2消化pE-SUMO3-SPINK6重组融合蛋白切下SUMO3-His标签。在4 ℃下,用80 μL SUMO蛋白酶2缓冲液(0.2 μg SUMO蛋白酶2,0.3 mg二硫苏糖醇,1 mL磷酸缓冲液(1×PBS),pH 7.4)分别消化100 μg重组融合蛋白2、6、10 h。
1.3.6 SDS-PAGE蛋白电泳在蛋白样品中加入上样缓冲液,于100 ℃金属浴加热5 min变性,吸取20 μL样品上样,用12% PAGE胶进行电泳分离(70 V,30 min; 100 V,90 min)。置于考马斯亮蓝R-250染色液中染色3 h,随后用脱色液(75 mL乙酸,50 mL甲醇,875 mL双蒸水)脱色直至蓝色背景褪去,有清晰的条带出现。
1.3.7 RP4-HPLC纯化酶消化后的混合物经过短暂离心后,将上清液用C4柱纯化。洗脱体系为流动相A(0.1% TFA)和流动相B(乙腈中加入0.1% TFA),流速为0.5 mL/min。设置洗脱条件如下:平衡柱子10 min,10%流动相B; 进样10 min,10%流动相B; 第一步洗脱20 min,流动相B由10%升至60%; 第二步洗脱10 min,流动相B由60%升至100%; 再生5 min,100%流动相B。检测215 nm波长处的吸光度,收集每个出峰位置的组分。
1.3.8 ESI-MS用电喷雾离子质谱仪(Electrospray ionization mass spectrometry,ESI-MS)鉴定经纯化后的蛋白。选择正电离模式,用碘化钠校正,将蛋白用体积分数为50%的乙腈溶液稀释10倍后以流速10 μL/min注入质谱仪,在m/z范围为280~2 000内扫描3 min,得到样品的质核比图谱,用最大熵反褶积法得到样品的质谱图谱。
1.3.9 重组SPINK6的活性检测在KLK5和KLK14中加入不同摩尔浓度的hSPINK6,在缓冲体系(0.1 mol/L Tris盐酸盐,150 mmol/L氯化钠,5 mmol/L EDTA,0.05%吐温20,pH 8.0)中孵育5 min。孵育后,在相同缓冲液中加入底物溶液,底物为N-(p-Tosyl)-Arg-Gly-Val 5-NA,控制酶的终摩尔浓度为2 nmol/L。使用酶标仪测量405 nm波长处的吸光度来监测反应的进展,通过线性回归确定不同SPINK6浓度的初始反应速度。根据莫里森紧密结合抑制模型分析,确定抑制常数Ki和标准误差。
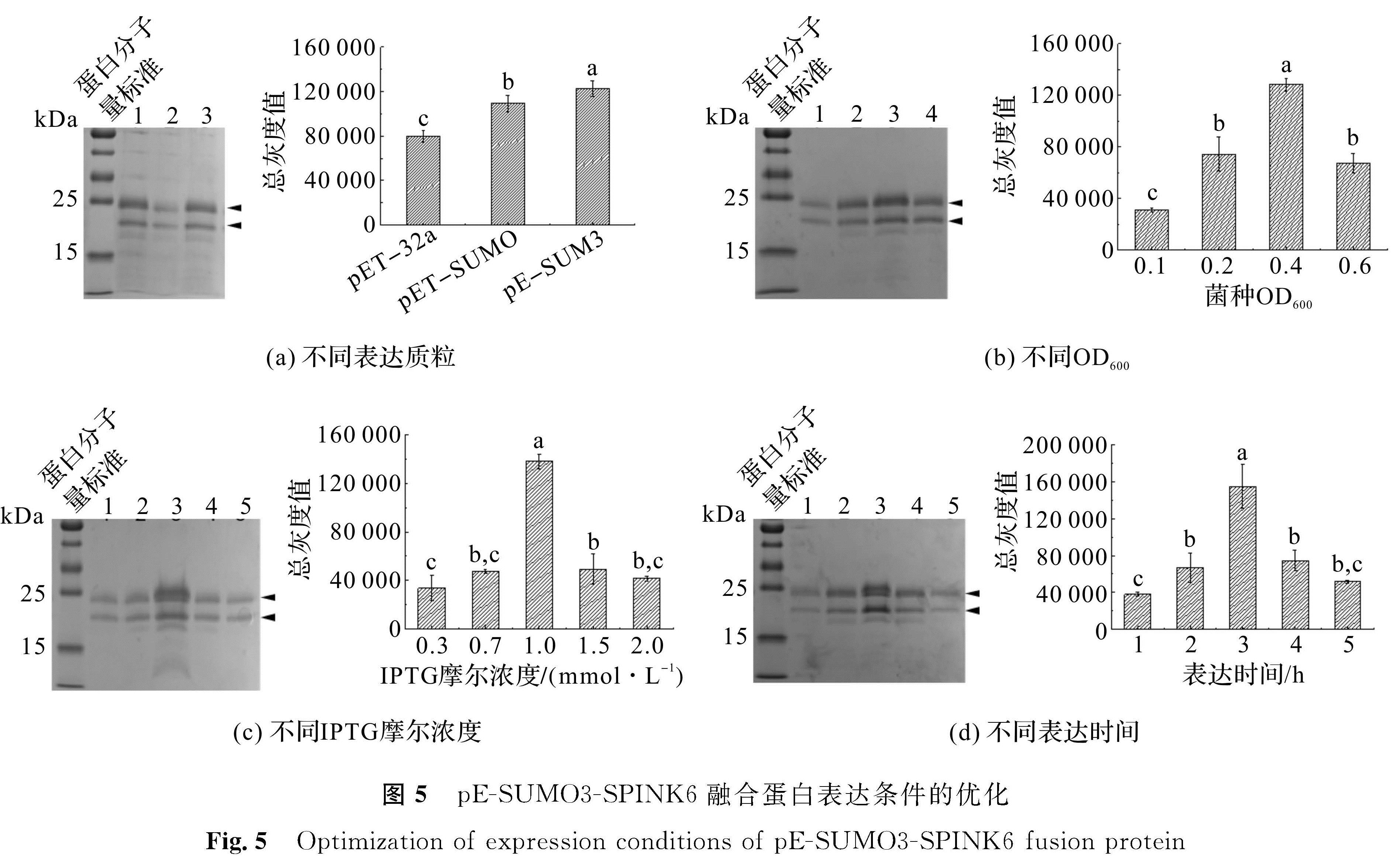
1.3.10 SPINK6重组蛋白表达条件的优化用单因素分析方法对SPINK6蛋白表达的最适条件进行探究。探究最佳的表达质粒,分别选用pET-32a、pET-SUMO和pE-SUOM3质粒构建的表达质粒导入大肠杆菌进行表达[6,13]。探究最佳表达初始菌体浓度,在菌液OD600分别为0.1、0.2、0.4、0.6时加入IPTG诱导表达。探究IPTG的最适诱导浓度,分别在0.3、0.7、1.0、1.5、2.0 mmol/L的IPTG摩尔浓度诱导下表达。探究最适表达时间,分别表达1、2、3、4、5 h。以上表达完成后分别提取胞内蛋白进行Ni2+-NTA和RP8-HPLC两步纯化,然后用SDS-PAGE分离。使用ImageJ计算目标蛋白的总灰度值,采用SPSS 22.0对其进行差异性分析。
2 结果与讨论2.1 pE-SUMO3-SPINK6重组表达质粒的构建与鉴定
为了得到SPINK6的重组表达质粒,我们将SPINK6的片段进行了扩增并插入pE-SUMO3中。由图1(a)和测序结果可知,SPINK6转录本成功从人包皮角质形成细胞总RNA中扩增得到,长度为322碱基对(base pair,bp)。为了将得到的目的片段连接到载体pE-SUMO3的BamHⅠ和BsaⅠ之间,我们以上述产物为模板,由图1(b)成功扩增得到了引入BsaⅠ和BamHⅠ这两个酶切位点的插入片段,测序结果可知其长度为241 bp。大肠杆菌TOP10菌株中扩增的质粒测序结果显示插入片段成功连入质粒的阅读框架中。
2.2 SPINK6重组融合蛋白的表达与纯化为了重组表达SPINK6融合蛋白,我们将构建好的表达质粒转化到大肠杆菌BL21(DE3)plysS中,在IPTG诱导下进行了表达。SDS-PAGE检测结果表明在约20千道尔顿(kilo Dalton,kDa)和24 kDa处有2条较强蛋白条带(结果未显示),阴性对照在相应的位置无蛋白条带。随后,我们对细胞裂解液进行了2步分离纯化。图2(a)显示了Ni2+-NTA纯化的洗脱曲线,随着流动相B的增加,在22~30 min获得1个洗脱峰,在Ni2+-NTA纯化过程中,大多数杂质直接流穿,而SPINK6重组融合蛋白因带有His标签而保留在柱上,因此分析该峰为SPINK6重组融合蛋白的洗脱峰。如图2(b)显示,出峰产物通过进一步的制备RP8-HPLC纯化,在38~42 min得到1个洗脱峰,反相高效液相色谱是通过物质的不同极性将物质分离,Ni2+-NTA纯化后留下了SPINK6重组融合蛋白和咪唑等盐类物质,咪唑等盐类物质极性较大先被洗脱下来,而SPINK6重组融合蛋白极性较小,后被洗脱下来,因此分析38~42 min的峰为SPINK6重组融合蛋白的洗脱峰。
2.3 SPINK6重组融合蛋白的酶切和鉴定
为获得SPINK6重组蛋白,4 ℃下酶切10 h时重组融合蛋白被完全消化,由图3(a)可知产生约11 kDa和6 kDa的两个条带,分别对应接头蛋白和目的蛋白。进一步对酶切产物进行RP4-HPLC纯化分析,洗脱峰进行ESI-MS检测,其m/z值分布在758.73至1 516.20之间(结果未显示)。通过最大熵反褶积得到了如图3(b)所示的分子量图谱,显示酶切后的产物分子量为6 061.51 Da。该分子量同预期的SPINK6理论分子量6 067.83 Da相比,少了6.32 Da,这对应6个H原子的质量总和,这表明表达的SPINK6重组蛋白带有3个二硫键[4]。
2.4 重组SPINK6的活性鉴定由于重组SPINK6蛋白已经带有3个二硫键,具备天然SPINK6的蛋白构象。为进一步探究重组SPINK6的抑制活性,我们用KLK5和KLK14测试了SPINK6的抑制效果。由图4可知,重组SPINK6对KLK5和KLK14的抑制常数分别为(3.02±0.26)nmol/L和(1.85±0.05)nmol/L,对KLK5和KLK14有较强的抑制作用,这说明通过此方法表达的重组SPINK6具有良好的活性,在极微量的浓度下就起到抑制作用。
2.5 SPINK6重组融合蛋白表达的优化
为了寻找SPINK6融合蛋白重组表达的最适条件,我们设计了4个单因素试验以探究其最适表达条件。由图5(a)可知,在pET-32a、pET-SUMO和pE-SUOM3这三种表达质粒中,通过pE-SUMO3表达SPINK6重组融合蛋白,产量最高(P<0.05)。由图5(b)可知,在OD600分别为0.1、0.2、0.4和0.6时加入IPTG开始诱导表达,其中OD600为0.4时加入IPTG开始表达,产量最高(P<0.05)。分别用0.3、0.7、1.0、1.5和2.0 mmol/L的IPTG诱导表达SPINK6重组融合蛋白,由图5(c)可知,在IPTG摩尔浓度为1 mmol/L诱导时,产量达到最高(P<0.05)。加入IPTG分别诱导表达1、2、3、4、5 h,收集表达产物,由图5(d)可知,表达3 h后收集的产物蛋白量最高(P<0.05)。综上所述,使用pE-SUMO3质粒,在OD600=0.4时加入1 mmol/L IPTG诱导表达3 h,为SPINK6重组融合蛋白表达的最适条件。通过上述方法表达及酶切纯化,我们在1 L培养液中获得重组SPINK6 3.32 mg。
图5 pE-SUMO3-SPINK6融合蛋白表达条件的优化
Fig.5 Optimization of expression conditions of pE-SUMO3-SPINK6 fusion protein
3 结 语
为了提高SPINK6重组蛋白的产量而对表达条件进行了优化,得出该系统在菌体OD600=0.4时加入1 mmol/L IPTG诱导表达3 h,可获得最大产量的SPINK6,为3.32 mg/L。本文方法为后续大规模发酵生产SPINK6提供了坚实的基础,并为SPINK6在医学上的研究和应用提供了参考。
- [1] MEYER-HOFFERT U. Reddish, scaly, and itchy: how proteases and their inhibitors contribute to inflammatory skin diseases[J].Archivum Immunologiae Et Therapiae Experimentalis,2009,57(5):345.
- [2] VEER S J D, FURIO L, SWEDBERG J E, et al. Selective substrates and inhibitors for Kallikrein-related peptidase 7(Klk7)shed light on Klk proteolytic activity in the stratum corneum[J].Journal of Investigative Dermatology,2017,137(2):432.
- [3] PAMPALAKIS G, SOTIROPOULOU G. Insights into the regulation of proteolytic pathways in skin differentiation[J].British Journal of Dermatology,2017,176(6):1525.
- [4] MCGOVERN J A, MRINERT C, VEER S J D, et al. Attenuated kallikrein-related peptidase activity disrupts desquamation and leads to stratum corneum thickening in human skin equivalent models[J].British Journal of Dermatology,2016,176(1):150.
- [5] FISCHER J, KOBLYAKOVA Y, LATENDORF T, et al. Cross-linking of SPINK6 by transglutaminases protects from epidermal proteases[J].Journal of Investigative Dermatology,2013,133(5):1174.
- [6] MEYER-HOFFERT U, WU Z H, KANTYKA T, et al. Isolation of SPINK6 in human skin[J].Journal of Biological Chemistry,2010,285(42):32174.
- [7] CHAVANAS S, BODEMER C, ROCHAT A, et al. Mutations in SPINK5, encoding a serine protease inhibitor, cause netherton syndrome[J].Nature Genetics,2000,25(2):141.
- [8] REDELFS L, FISCHER J, WEBER C, et al. The serine protease inhibitor of Kazal-type 9(SPINK9)is expressed in Lichen simplex chronicus, actinic keratosis and squamous cell carcinoma[J].Archives of Dermatological Research,2016,308(2):135.
- [9] WU Z H, WU Y Y, FISCHER J, et al. Skin-derived SPINK9 kills Escherichia Coli[J].Journal of Investigative Dermatology,2019,139(5):1135.
- [10] TOILLON R A, LAGADEC C, PAGE A, et al. Proteomics demonstration that normal breast epithelial cells can induce apoptosis of breast cancer cells through insulin-like growth factor-binding protein-3 and maspin[J].Molecular & Cellular Proteomics,2007,6(7):1240.
- [11] LU H R, HUANG J J, LI G D, et al. Expression, purification and characterization of recombinant human serine proteinase inhibitor Kazal-type 6(SPINK6)in Pichia Pastoris[J].Protein Expression & Purification,2012,82(1):145.
- [12] 高云,黄宇烽.真核表达系统的研究进展[J].中华男科学,2002,8(4):292.
- [13] WU Z H, HANSMANN B, MEYER-HOFFERT U, et al. Molecular identification and expression analysis of filaggrin-2, a member of the S100 fused-type protein family[J].PLOS ONE,2009,4(4):e5227.
- [14] 马琳,申春平.特应性皮炎与皮肤屏障相关性研究进展[J].皮肤病与性病,2011,33(2):80.
- [15] PRASSAS I, EISSA A, PODA G, et al. Unleashing the therapeutic potential of human kallikrein-related serine proteases[J].Nature Reviews Drug Discovery,2015,14(10):732.
- [16] FISCHER J, WU Z H, KANTYKA T, et al. Characterization of SPINK6 in mouse skin: the conserved inhibitor of Kallikrein-related peptidases is reduced by barrier injury[J].Journal of Investigative Dermatology,2014,134(5):1306.
 图 1 SPINK6基因的转录本扩增
Fig.1 Amplification of SPINK6 transcript
图 1 SPINK6基因的转录本扩增
Fig.1 Amplification of SPINK6 transcript