食盐是人类日常饮食中不可或缺的调料之一,它除了维持细胞渗透压之外,还与一些疾病如高血压、肥胖等密切相关[1]。竹盐是将日晒海盐放入新鲜楠竹桶中,用黄土封盖,以松枝为燃料,在800~1 300 ℃高温下煅烧而成。经过9次煅烧的竹盐,因其颜色表现为蓝紫色,又称之为紫竹盐[2]。
经过高温煅烧,竹盐与竹筒、黄土中的微量元素充分融合,使得其中金属元素(如钙、硅、钾、镁、铁、锌、硒等)的种类和含量均高于普通食盐; 此外,高温煅烧还可以有效降低砷、铅和汞等重金属及有机污染物(二噁英和多氯联苯等)含量,因而具备了一些独特的功能。金属微量元素是人体所必需的矿物元素,对人体的生理健康起重要作用。人体的一些疾病与某些金属微量元素的失衡有关,一旦高于或者低于平衡水平,就可能会引发人体疾病[3]。目前,对竹盐的研究主要集中在1次煅烧制得的竹盐上,且主要研究其抗氧化[4-5]、抗炎[6-7]、抑菌[8]、保护肝脏、治疗胃肠道疾病[9-10]、抑制肿瘤细胞增殖[11-12]及抗皮肤衰老[13-14]等方面。紫竹盐是经过9次煅烧工艺而制得的产品,其矿物元素含量多于1次煅烧竹盐、精制海盐和粗海盐,与1次煅烧竹盐相比,紫竹盐具有更好的生理活性和保健功效。目前关于紫竹盐对抗细胞炎症和抗肝癌的作用研究较少,因此,研究紫竹盐抗炎活性的功效及对肝癌细胞和正常肝细胞凋亡的影响,能为紫竹盐产品的进一步开发提供理论依据。
1 材料与方法1.1 材料与仪器紫竹盐、精制海盐、粗海盐,浙江临安三和园竹盐食品有限公司; 鹰的最小培养基(minimum eagle's medium,MEM)、达尔伯克改良鹰的培养基(Dulbecco's modified eagle's medium,DMEM)、胎牛血清、紫杉醇、青霉素、链霉素、人肝癌细胞(HepG2)、人正常肝细胞(WRL68),武汉普诺赛生命科技有限公司; 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT),脂多糖(lightning protection system,LPS),赛国生物科技有限责任公司; 格里斯试剂盒(Griess试剂盒)、聚氰基丙烯酸正丁酯试剂盒(BCA试剂盒)、肿瘤坏死因子-α试剂盒(TNF-α试剂盒)、白细胞介素-1β试剂盒(IL-1β试剂盒)、细胞凋亡检测试剂盒(Annexin V-FITC试剂盒),武汉博士德生物工程有限公司; 小鼠单核巨噬细胞(RAW264.7),上海富衡生物科技有限公司; 多功能酶标仪(SpectraMax iD3),美谷分子仪器有限公司; 二氧化碳培养箱(BB150)、A2型Ⅱ级生物安全柜(MSC-AdvantageTM),美国赛默飞世尔科技公司; 倒置显微镜(CKX53),日本奥林巴斯公司; CytoFLEX流式细胞仪,美国贝克曼库尔特有限公司。
1.2 试验方法1.2.1 紫竹盐、精制海盐和粗海盐对RAW264.7细胞炎症的影响的测定1.2.1.1 RAW264.7细胞传代培养 RAW264.7细胞复苏后,用质量分数为10%的胎牛血清的DMEM培养液,于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养。传至3代后,待细胞状态稳定后分组试验。
1.2.1.2 紫竹盐、精制海盐和粗海盐对RAW264.7细胞增殖的测定 试验分组:配制最终样品质量分数分别0%、0.1%、0.2%、0.4%、0.6%和0.8%的DMEM细胞培养液。在96孔板中加入混合均匀的细胞悬浮液100 μL(每孔1×104个细胞),培养24 h后弃培养液,按上述分组加入100 μL盐样品培养基,于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养24 h。采用MTT法[11]测定不同质量分数样品对细胞存活率的影响。
1.2.1.3 紫竹盐、精制海盐和粗海盐对LPS诱导的RAW264.7细胞因子的影响的测定 将RAW264.7细胞计数,在24孔板中加入混合均匀的细胞悬浮液1 mL(每孔1×105个细胞),于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养24 h,分组试验,每组3个复孔。试验分组:正常对照组、LPS组(1 mg/L)、LPS(1 mg/L)+质量分数为0.1%的粗海盐组、LPS(1 mg/L)+质量分数为0.1%的精制海盐组、LPS(1 mg/L)+质量分数为0.1%的紫竹盐组。弃培养液,按上述分组各孔加入1 mL盐样品培养基,于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养再24 h,每组设置3个复孔,收集细胞上清液,采用Griess试剂盒测定不同盐样品对RAW264.7细胞的NO释放量,采用TNF-α、IL-1β试剂盒测定上清液中TNF-α、IL-1β的含量。收集上清液,采用BCA蛋白浓度测定试剂盒测定每孔蛋白含量。
1.2.2 紫竹盐、精制海盐和粗海盐对HepG2细胞和WRL68细胞增殖及凋亡的影响的测定1.2.2.1 HepG2细胞和WRL68细胞传代培养 HepG2和WRL68细胞复苏后,分别用质量分数为10%的胎牛血清的MEM和DMEM培养液于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养。传至3代后,待细胞状态稳定后分组试验。
1.2.2.2 细胞存活率检测 分别在96孔板中加入100 μL的HepG2和WRL68细胞悬液(每孔1×104个细胞),培养24 h,弃培养液,加入100 μL最终盐样品质量分数分别为0.1%、0.2%、0.4%、0.6%和0.8%的细胞培养液,每组设置6个复孔,于37 ℃、体积分数为5%的CO2及饱和湿度的培养箱中培养24 h,采用MTT法测定不同质量分数样品对细胞存活率的影响。
1.2.2.3 流式细胞仪检测细胞凋亡 细胞培养和处理方法同1.2.2.2节,收集经0.6%质量分数的盐样品处理过的细胞,磷酸缓冲盐溶液润洗2次后重悬细胞计数,取1×105重悬的细胞,1 000 g离心5 min,弃上清液,依次加入195 μL Annexin V-FITC结合液、5 μL Annexin V-FITC、10 μL碘化丙啶染色液,轻轻混匀,室温避光孵育10~20 min,置于冰浴中备用。用流式细胞仪检测并记录数据。
1.2.3 数据统计学处理试验数据采用平均值±标准差表示,用SPSS19.0软件进行统计学及显著性分析,用Origin8.0软件绘制图表。
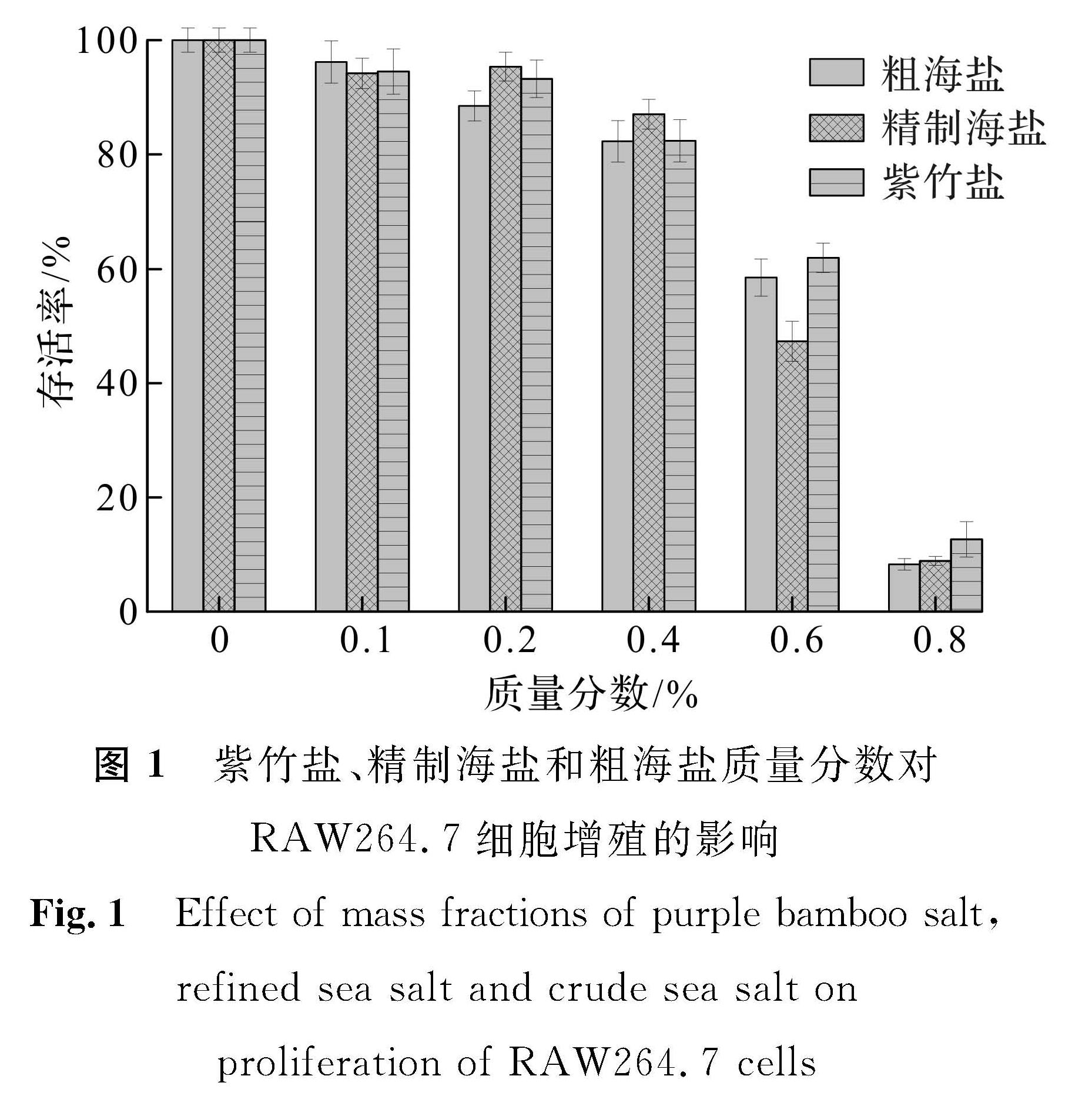
图1 紫竹盐、精制海盐和粗海盐质量分数对RAW264.7细胞增殖的影响
Fig.1 Effect of mass fractions of purple bamboo salt, refined sea salt and crude sea salt on proliferation of RAW264.7 cells
2 结果与分析2.1 紫竹盐、精制海盐和粗海盐对RAW264.7细胞的影响结果分析2.1.1 紫竹盐、精制海盐和粗海盐对RAW264.7细胞增殖的影响结果分析
紫竹盐、精制海盐和粗海盐质量分数对RAW264.7细胞增殖的影响如图1所示。经MTT法检测发现,质量分数为0.1%的盐样品作用于RAW264.7细胞24 h后,与对照组相比,细胞活力无显著性差异。而随着盐样品质量分数的增大,RAW264.7细胞的存活率与盐样品质量分数呈负相关。这可能是随着盐质量分数的增大,细胞培养基中的渗透压也会增加,从而影响细胞生长,故我们选择质量分数为0.1%的盐样品进行后续试验。
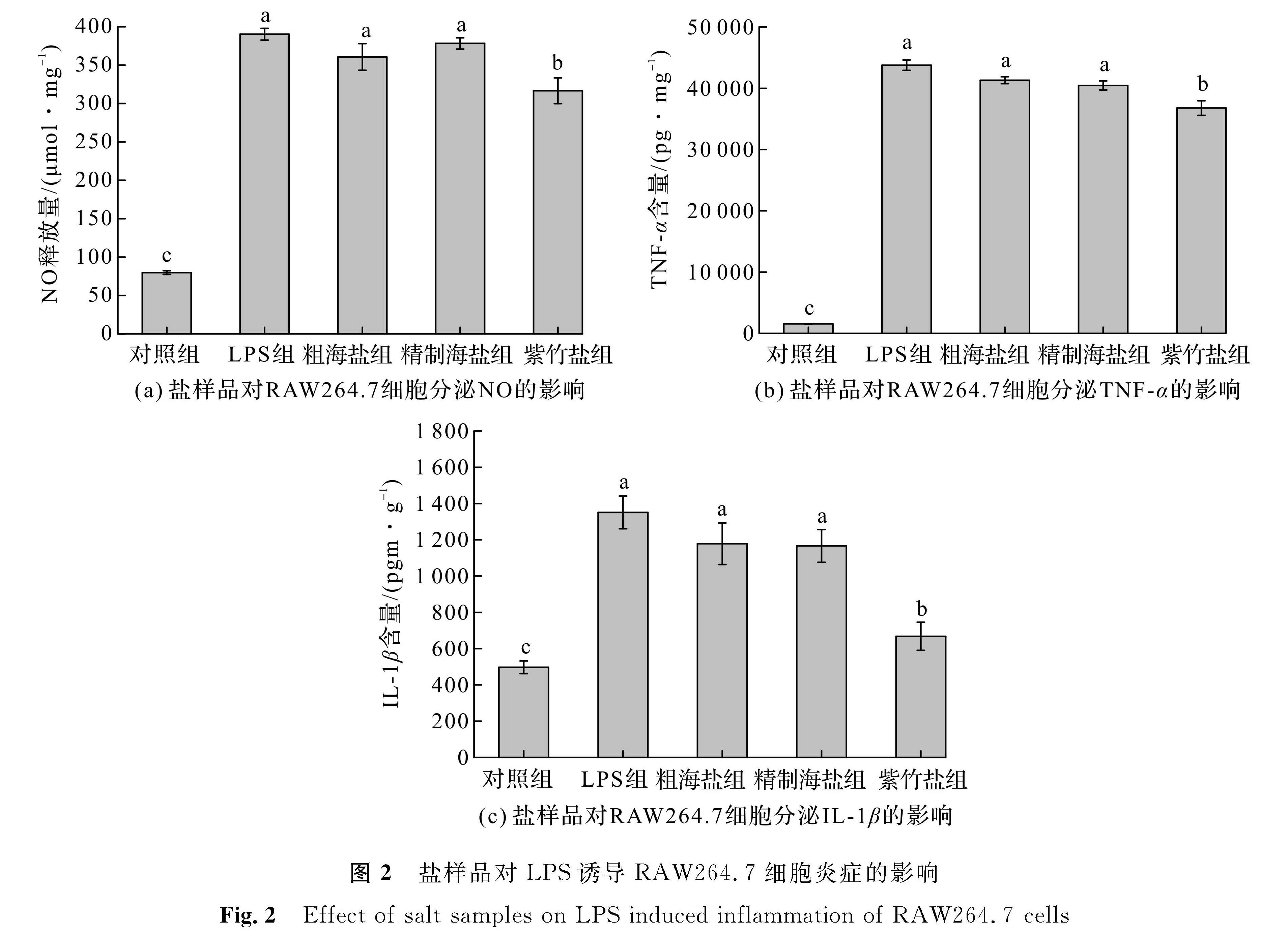
2.1.2 紫竹盐、精制海盐和粗海盐对RAW264.7细胞炎症的影响结果分析当LPS对RAW264.7细胞产生刺激时,RAW264.7细胞会被激活,产生炎症介质NO和炎症细胞因子TNF-α、IL-1β等,故测定炎症细胞因子TNF-α、IL-1β的含量是评价炎症严重程度的重要指标[15-16]。根据林杨等[17]的研究结果,选择质量浓度为1 mg/L的LPS进行后续试验。图2为盐样品对LPS诱导RAW264.7细胞炎症的影响,其中a表示在相同质量分数下与LPS组无显著性差异,b表示在相同质量分数下与LPS组有显著性差异,c表示在相同质量分数下与紫竹盐组有显著性差异。由图2(a)可知,与对照组相比,LPS组RAW264.7细胞的NO释放量提高极显著(p<0.01)。粗海盐组和精制海盐组与LPS组相比,RAW264.7细胞的NO释放量均无显著性差异(p>0.05),而紫竹盐组可显著降低RAW264.7细胞的NO释放量(p<0.05),说明紫竹盐具有一定的抗炎作用。由图2(b)和(c)可知,LPS组中TNF-α、IL-1β的含量显著高于对照组(p<0.05)。粗海盐组和精制海盐组与LPS组相比,RAW264.7细胞中TNF-α、IL-1β的含量均无显著性差异,而紫竹盐组可显著降低LPS诱导的RAW264.7细胞中TNF-α、IL-1β的含量(p<0.05)。上述试验结果表明:紫竹盐可通过下调RAW264.7细胞中TNF-α、IL-1β的分泌而起到抗炎作用。尹湘君[18]的研究表明石膏水煎液对LPS诱导的RAW264.7细胞炎症反应模型有一定的抗炎药效,其发挥抗炎药效的物质基础是有Ca元素,Ca元素可以通过影响TLR4/NF-κB通路而发挥其抗炎作用。紫竹盐相比精制海盐和粗海盐,含有一定量的Ca元素,故能发挥一定的抗炎功效。
图2 盐样品对LPS诱导RAW264.7细胞炎症的影响
Fig.2 Effect of salt samples on LPS induced inflammation of RAW264.7 cells
2.2 紫竹盐、精制海盐和粗海盐对HepG2细胞和WRL68细胞的影响结果分析2.2.1 紫竹盐、精制海盐和粗海盐对HepG2细胞和WRL68细胞增殖的影响结果分析
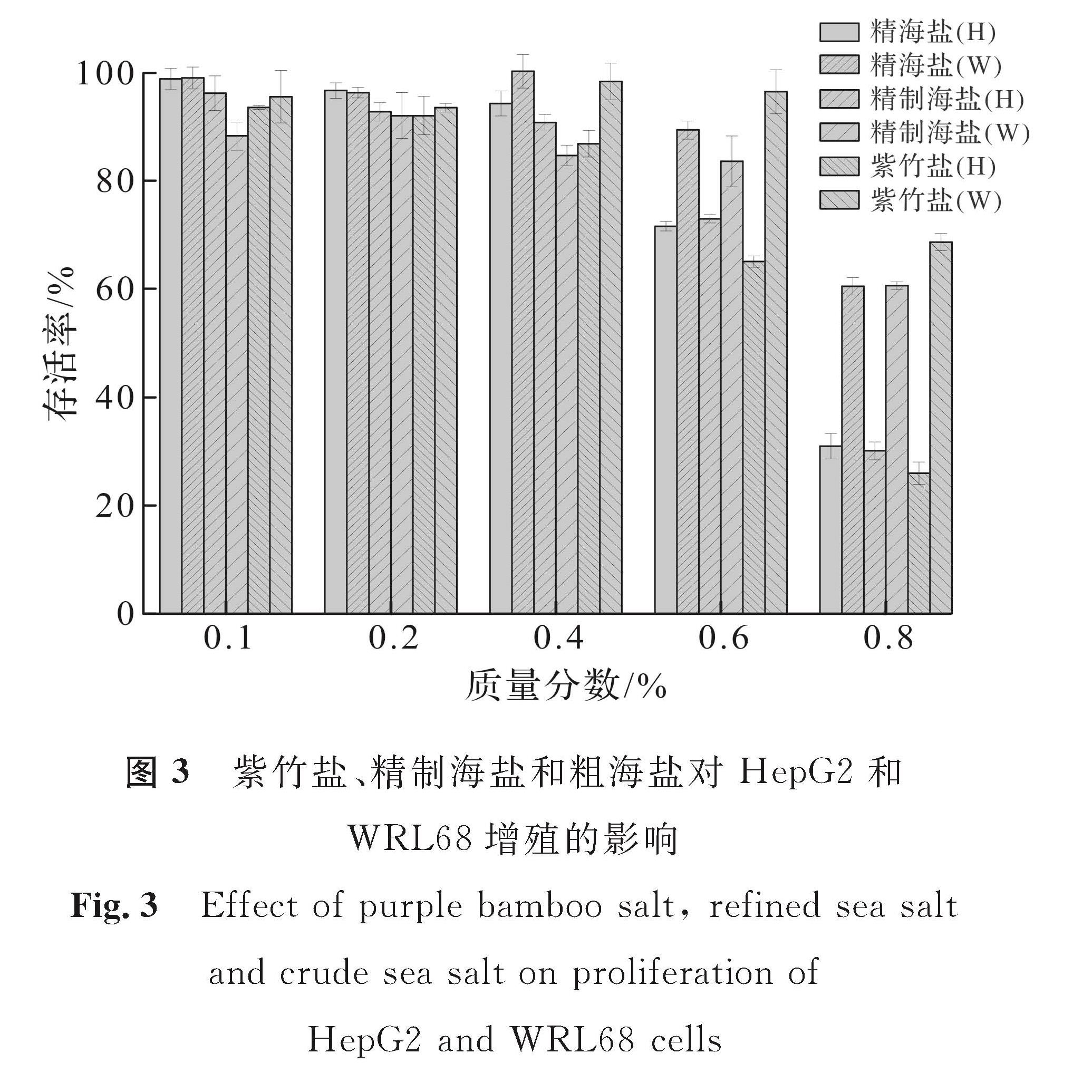
紫竹盐、精制海盐和粗海盐对HepG2和WRL68增殖的影响如图3所示,从图中可以看出(H代表HepG2细胞,W代表WRL68细胞),在0.1%~0.8%的质量分数范围内,随着盐质量分数的增大,3种盐样品对HepG2和WRL68细胞的抑制率呈质量分数依赖关系,在高质量分数下,其样品对HepG2和WRL68细胞有很大的毒性。对于HepG2细胞,在盐质量分数为0.6%时,粗海盐组和精制海盐组存活率为75%,而紫竹盐组存活率为63%。在盐质量分数为0.8%时,粗海盐组和精制海盐组存活率降至30%,而紫竹盐组存活率降至25%。
图3 紫竹盐、精制海盐和粗海盐对HepG2和WRL68增殖的影响
Fig.3 Effect of purple bamboo salt, refined sea salt and crude sea salt on proliferation of HepG2 and WRL68 cells
对于WRL68细胞,在盐质量分数为0.6%时,粗海盐组和精制海盐组存活率为80%,紫竹盐组存活率为95%; 而在盐质量分数为0.8%时,粗海盐组和精制海盐组存活率降至65%,紫竹盐组存活率降至75%。试验结果表明,紫竹盐抑制肝癌增殖效果优于粗海盐和精制海盐,而对WRL68细胞的损伤程度小于粗海盐和精制海盐。陈湄沁[19]的研究表明竹盐和岩盐对正常人胃黏膜细胞(GES1)无明显影响,对人胃癌细胞(SGC7901和BGC823)和人肠癌细胞(Caco2)3种胃肠道癌细胞具有较好的体外增殖抑制效果,且竹盐的抗癌效果优于岩盐; 同时还表明细胞的耐酸性要强于耐碱性,甚至有一些细胞在偏酸环境中更易生长,癌细胞生长环境pH值一般为6.85~6.95,癌细胞在酸性体液环境下很容易生长和扩散,而紫竹盐的pH值呈明显的弱碱性,可以推测紫竹盐可能通过调节体液酸碱度,诱导细胞凋亡。
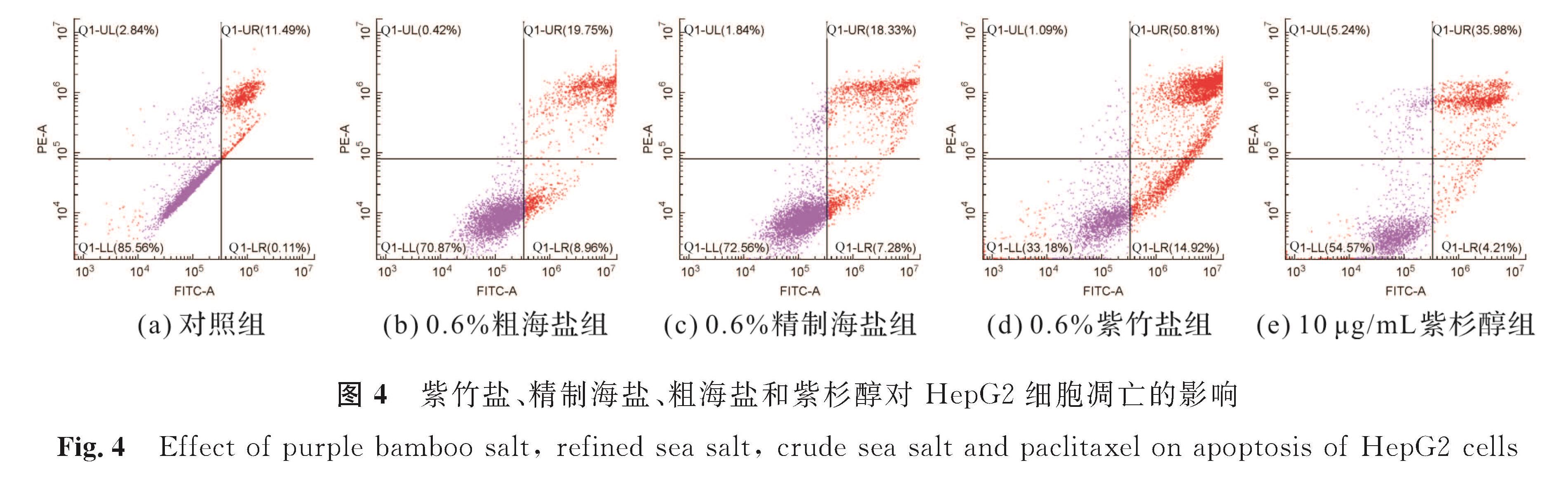
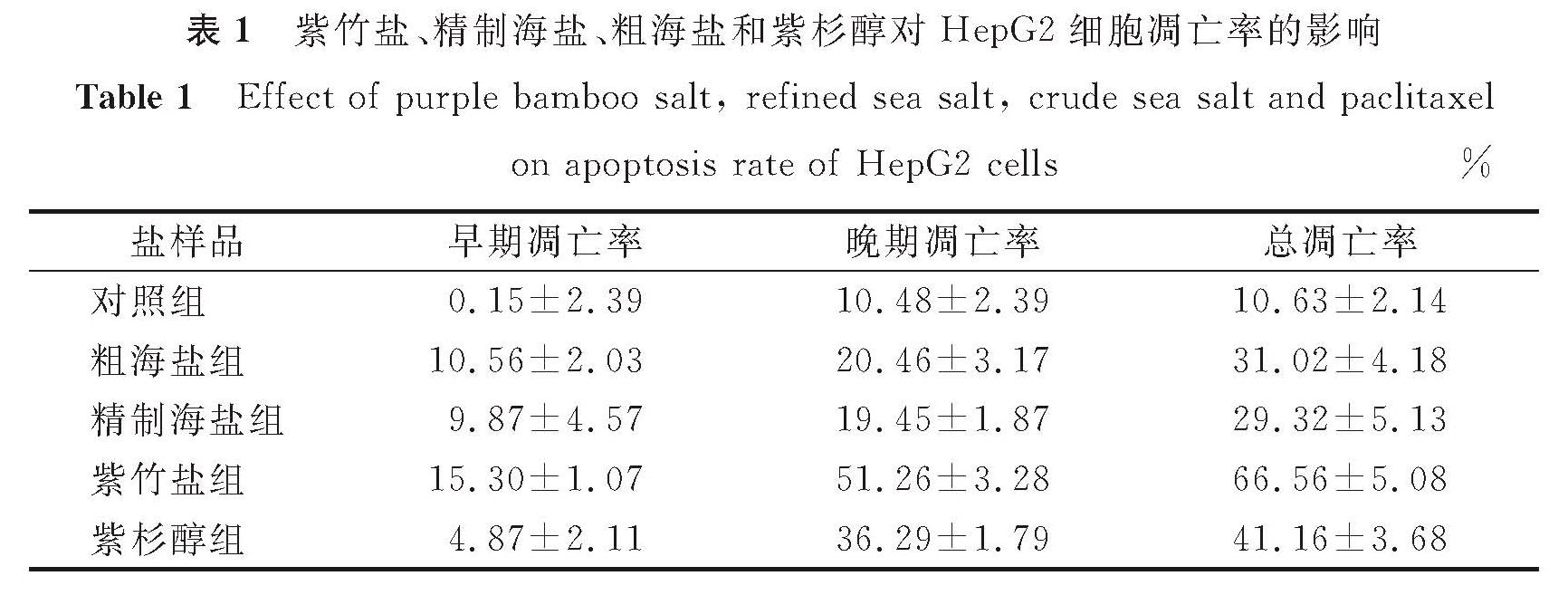
2.2.2 紫竹盐、精制海盐和粗海盐对HepG2细胞凋亡影响的结果分析由2.2.1节可知,在盐质量分数较高时(0.8%),3种盐样品均对HepG2细胞产生较大毒性,细胞存活率低于30%,坏死细胞过多,不易进行凋亡率测定; 在盐质量分数较低时(0.1%~0.4%),3种盐样品对HepG2细胞毒性较弱,细胞存活率均大于80%,细胞凋亡区别不显著; 而在盐质量分数为0.6%时,3种盐样品开始对HepG2细胞产生毒性,细胞存活率低于70%,故选取质量分数为0.6%的盐样品处理细胞。紫杉醇是世界公认的强活性广谱抗癌药物,研究表明其对多种肿瘤细胞具有抑制增殖,诱导凋亡的作用[20],故选择10 μg/mL的紫杉醇作为阳性对照组。图4为紫竹盐、精制海盐、粗海盐和紫杉醇对HepG2细胞凋亡的影响,其中红色表示凋亡细胞部分,紫色表示存活细胞和坏死细胞部分,Q1-UL代表死细胞,Q1-UR代表晚期凋亡细胞,Q1-LR代表早期凋亡细胞,Q1-LL代表正常细胞,FITC-A代表指示剂FITC,PE-A代表PE通道信号。由图4可知,采用质量分数为0.6%的盐样品作用于HepG2细胞24 h后,与对照组相比,紫竹盐组可显著促进HepG2细胞的凋亡,且促凋效果优于粗海盐组、精制海盐组和紫杉醇组。紫竹盐、精制海盐、粗海盐和紫杉醇对HepG2细胞凋亡率的影响见表1。由表1可知,质量分数为0.6%的盐样品作用HepG2细胞24 h后,紫竹盐组的总凋亡率(66.56%±5.08%)高于粗海盐组(31.02%±4.18%)、精制海盐组(29.32%±5.13%)和紫杉醇组(41.16%±3.68%)。紫竹盐主要促进肝癌细胞的晚期凋亡,高达51.26%±3.28%。Yi等[12]的研究表明,不同煅烧次数的竹盐对抑制小鼠体内的肿瘤增殖效果存在显著差异,其中9烤竹盐对肿瘤增殖抑制效果优于3烤竹盐、1烤竹盐,且不同煅烧次数的竹盐对抑制肿瘤增殖效果均优于精制食盐和原盐,与本试验的结果类似。紫竹盐是经过9次煅烧制得,紫竹盐里K、Ca、Mg、Fe等元素的含量随煅烧次数增多而增加,同时紫竹盐比精制海盐和粗海盐具有更多的羟基,故表现出一定的抗癌活性。
图4 紫竹盐、精制海盐、粗海盐和紫杉醇对HepG2细胞凋亡的影响
Fig.4 Effect of purple bamboo salt, refined sea salt, crude sea salt and paclitaxel on apoptosis of HepG2 cells
表1 紫竹盐、精制海盐、粗海盐和紫杉醇对HepG2细胞凋亡率的影响
Table 1 Effect of purple bamboo salt, refined sea salt, crude sea salt and paclitaxel on apoptosis rate of HepG2 cells%
2.2.3 紫竹盐、精制海盐和粗海盐对WRL68细胞凋亡的影响结果分析
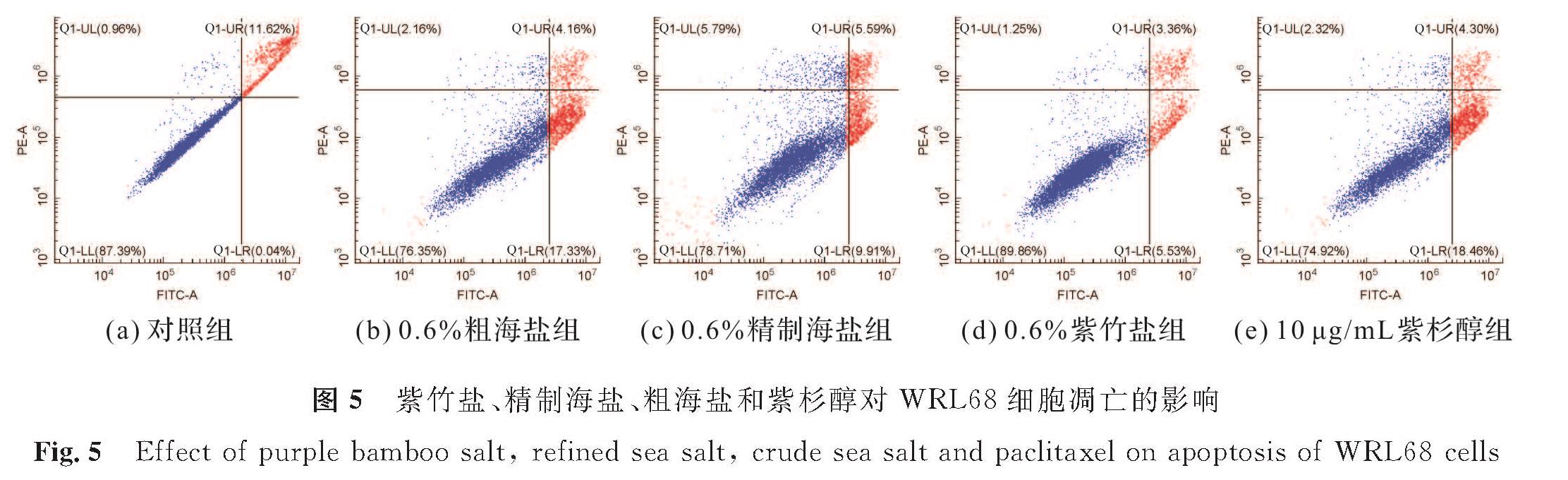
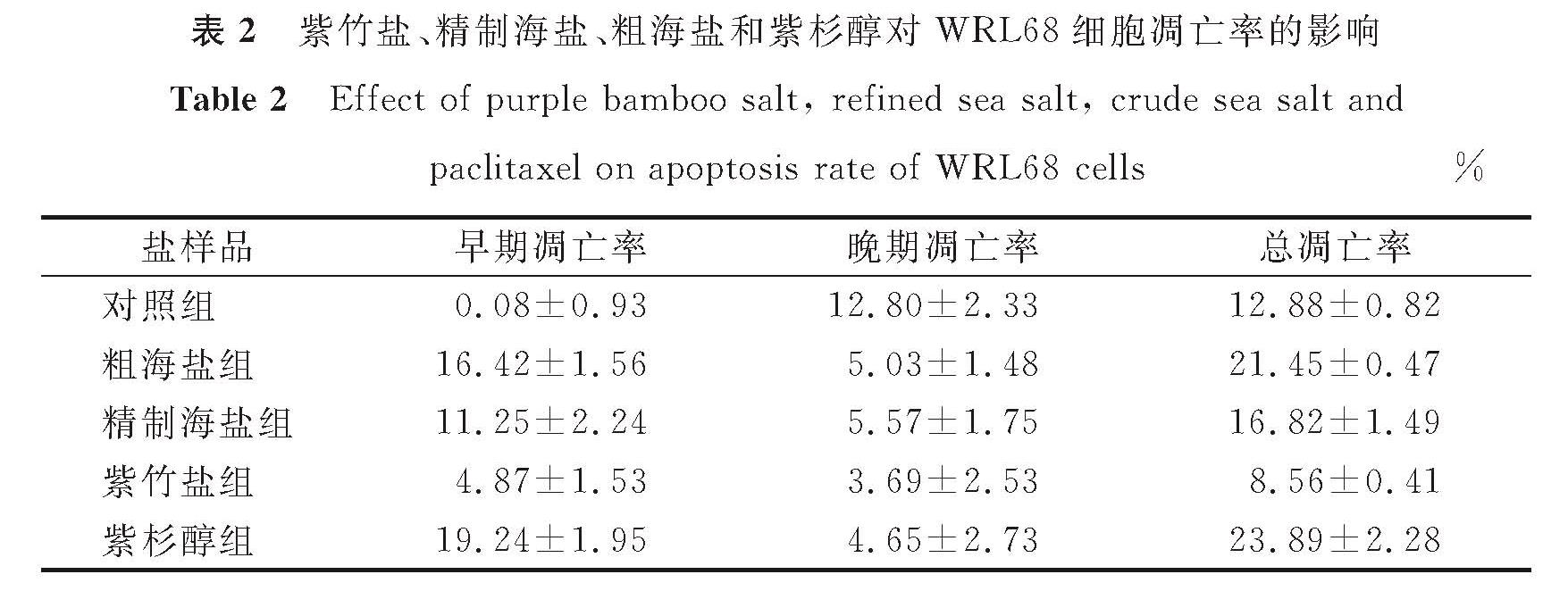
根据2.2.2节,采用质量分数为0.6%的盐样品处理WRL68细胞。图5为紫竹盐、精制海盐、粗海盐和紫杉醇对WRL68细胞凋亡的影响,其中红色表示凋亡细胞部分,蓝色表示存活细胞和坏死细胞部分,Q1-UL代表死细胞,Q1-UR代表晚期凋亡细胞,Q1-LR代表早期凋亡细胞,Q1-LL代表正常细胞,FITC-A代表指示剂FITC,PE-A代表PE通道信号。由图5可知,与对照组相比,紫竹盐组WRL68细胞的凋亡率远低于粗海盐组、精制海盐组和紫杉醇组,说明紫竹盐对WRL68细胞凋亡的影响较小。紫竹盐、精制海盐、粗海盐和紫杉醇对WRL68细胞凋亡率的影响见表2。由表2可知,质量分数为0.6%的盐样品作用于WRL68细胞24 h后,与对照组相比,紫竹盐组的细胞凋亡率为8.56%±0.41%,远低于紫杉醇组(23.89%±2.28%)、粗海盐组(21.45%±0.47%)和精制海盐组(16.82%±1.49%)。试验结果表明,紫杉醇作为抗癌药物,诱导HepG2细胞凋亡的同时也会诱导WRL68细胞凋亡。而在盐质量分数较高时,紫竹盐对WRL68细胞的损伤程度低于粗海盐、精制海盐和紫杉醇。Zhao等[21]的研究表明,竹盐可以显著降低肝损伤的大鼠血清中天门冬氨酸氧基转移酶和谷氨酸氨基转移酶的活性,降低大鼠肝脏组织的受损程度,表明竹盐对正常组织和细胞具有一定的保护作用,与本试验的结果类似。
图5 紫竹盐、精制海盐、粗海盐和紫杉醇对WRL68细胞凋亡的影响
Fig.5 Effect of purple bamboo salt, refined sea salt, crude sea salt and paclitaxel on apoptosis of WRL68 cells
表2 紫竹盐、精制海盐、粗海盐和紫杉醇对WRL68细胞凋亡率的影响
Table 2 Effect of purple bamboo salt, refined sea salt, crude sea salt and paclitaxel on apoptosis rate of WRL68 cells%
3 结 论
本研究对比分析了粗海盐、精制海盐和紫竹盐对LPS诱导RAW264.7细胞的炎症和肝癌细胞增殖的影响,试验结果表明:紫竹盐能显著抑制RAW264.7细胞的NO释放及降低TNF-α、IL-1β分泌,显著抑制肝癌细胞的增殖。在盐质量分数为0.6%时,紫竹盐对肝癌细胞的凋亡率高达66.56%±5.08%,高于紫杉醇(41.16%±3.68%)、粗海盐(31.02%±4.18%)和精制海盐(29.32%±5.13%); 在相同质量分数情况下,紫竹盐对正常肝细胞的凋亡率为8.56%±0.41%,远低于紫杉醇(23.89%±2.28%)、粗海盐(21.45%±0.47%)和精制海盐(16.82%±1.49%)。因此,紫竹盐抗炎活性优于粗海盐和精制海盐,对肝癌细胞的抑制作用优于紫杉醇、粗海盐和精制海盐,它对正常肝细胞的损伤程度低于紫杉醇、粗海盐和精制海盐。紫竹盐作为一种功能性盐,可以作为功能性食品添加剂代替部分普通食盐,具有较好的应用前景。
- [1] BREY C W, AKBARI-ALAVIJEH S, LING J, et al. Salts and energy balance: a special role for dietary salts in metabolic syndrome[J].Clinic Nutrition,2018,38(5):1.
- [2] 张建民.一种紫竹盐的制备方法:CN104783125A[P].2015-05-08.
- [3] 朱磊.微量元素在骨质疏松防治中的作用[J].上海医药,2012,33(8):43.
- [4] 陈亮.竹盐传统工艺改良及新品护肝功效研究[D].杭州:浙江大学,2019.
- [5] 骞宇,赵欣.竹盐的碱性特性和抗氧化效果[J].中国调味品,2014,39(2):28.
- [6] LEE H J, CHOI C H. Anti-inflammatory effects of bamboo salt and sodium fluoride in human gingival fibroblastse: an in vitro study[J].Kaohsiung Journal of Medical Sciences,2015,31(6):303.
- [7] YOOU M S, NAM S Y, YOON K W, et al. Bamboo salt suppresses skin inflammation in mice with 2,4-dinitrofluorobenzene-induced atopic dermatitis[J].中国天然药物(英文版),2018(2):97.
- [8] RYU E H, LEE S J, SHIN D, et al. Study on mineral concentration changes and anticariogenic effects of organic bamboo salt with different number of baking times[J].Journal of Agriculture ang Life Science,2018,52(1):61.
- [9] JEONG J H, NOH M Y, CHOI J H, et al. Neuroprotective and antioxidant activities of bamboo salt soy sauce against H2O2-induced oxidative stress in rat cortical neurons[J].Experimental and Therapeutic Medicine,2016,11(1):1201.
- [10] 陈亮,周沫希,严雅丽,等.植物功能盐对小鼠急性化学性肝损伤的防护实验研究[J].中国调味品,2019,44(5):33.
- [11] JU J, LEE G Y, KIM Y S, et al. Bamboo salt suppresses colon carcinogenesis in C57BL/6 mice with chemically induces colitis[J].Journal of Medical Food,2016,19(11):1015.
- [12] YI R, QI Y C, ZHAO X, et al. Anti-tumor activities of bamboo salt on sarcoma 180 tumor-bearing BALB/c mice[J].Biomedical Research-India,2017,28(9):4043.
- [13] ZHAO X, QI Y C, YI R, et al. Anti-ageing skin effects of Korean bamboo salt on SKH1 hairless mice[J].The International Journal of Biochemistry and Cell Biology,2018,103(7):1.
- [14] 严雅丽,周沫希,姜春鹏,等.新型功能性植物盐美白功效的体外评价[J].精细化工,2020,37(5):1002.
- [15] 毛超一,郭丛,王跃生.早小洋菊和射阳大白菊对脂多糖诱导RAW 264.7细胞炎症反应影响的差异[J].中医杂志,2020,61(8):711.
- [16] 王萌,郭泽,周鸿缘,等.黄芪总黄酮对巨噬细胞RAW 264.7抗炎免疫的双向调节研究[J].中国预防兽医学报,2020,42(8):822.
- [17] 林杨,杨平,张琦,等.蓝莓花色苷对脂多糖诱导RAW 264.7细胞炎症及结肠癌细胞增殖、凋亡的影响[J].食品科学,2020,41(13):133.
- [18] 尹湘君.基于Ca等无机元素探讨石膏抗炎作用机制研究[D].北京:北京中医药大学,2019.
- [19] 陈湄沁.竹盐和岩盐的生物学功效研究[D].杭州:浙江大学,2015.
- [20] 徐雅玲,梁菁.紫杉醇对肝癌细胞HepG2和大鼠原代培养肝细胞增殖抑制和诱导凋亡作用的研究[J].中国药理学通报,2018,34(7):993.
- [21] ZHAO X, JU J H, KIM H M. Antimutagenic activity and in vitro anticancer effects of bamboo salt on HepG2 human hepatoma cells[J].Journal of Environmental Pathology, Toxicology and Oncology,2013,32(1):9.
 图 1 紫竹盐、精制海盐和粗海盐质量分数对RAW264.7细胞增殖的影响
Fig.1 Effect of mass fractions of purple bamboo salt, refined sea salt and crude sea salt on proliferation of RAW264.7 cells
图 1 紫竹盐、精制海盐和粗海盐质量分数对RAW264.7细胞增殖的影响
Fig.1 Effect of mass fractions of purple bamboo salt, refined sea salt and crude sea salt on proliferation of RAW264.7 cells