激肽释放酶相关蛋白酶(kallikrein-related peptidases,KLKs)是一类丝氨酸蛋白酶,包含15个成员[1],具有胰蛋白酶活性和胰凝乳蛋白酶活性[2]。其中,KLK5和KLK7的作用在于调节丝聚蛋白(filaggrin,FLG)的降解与天然保湿因子的形成及皮肤正常的生理脱屑[3-4]。KLK8和KLK14通过介导丝氨酸蛋白酶参与调节皮肤表皮屏障的形成[5-6]。此外,一种合成的KLK1抑制剂被证明可以抑制乳腺癌细胞的侵袭,这表明KLKs可以被用于靶向抗癌治疗[7-8]。
KLKs的活性通常由相应的丝氨酸蛋白酶抑制剂Kazal型(serine protease inhibitor Kazal-type,SPINKs)控制[9-10]。目前,关于KLKs蛋白的鉴定和功能分析已相对完整,而对抑制剂SPINKs的了解却非常有限。SPINK5基因的突变会导致皮肤内瑟顿综合征发生[11-12],并且KLK5和SPINK5的相对表达是口腔鳞状细胞癌中一个重要的预后标志物[13-14]。沉默SPINK7能够抑制白细胞介素-22(interleukin-22,IL-22)诱导的细胞增殖和炎症应答反应,其机制可能与抑制Wnt/β-catenin信号通路有关,这为银屑病的诊断提供了新的标志物和治疗靶点[15]。SPINK9既是KLK5的选择性抑制剂,又是一种大肠杆菌选择性抗菌肽[16-17]。SPINK9诱导嘌呤能型2(Purinergic2,P2)受体的激活可以触发多种细胞信号通路,促进细胞迁移,加速创伤愈合[18]。然而,目前关于SPINKs对KLKs动态调控的协调性知之甚少,原因在于SPINKs成员的鉴定仍待完善。
迄今为止,已经发现的人体KLKs蛋白成员有15个,而其中明确对KLKs有抑制作用的SPINKs成员只有SPINK5、SPINK6和SPINK9[19]。我们发现了一个SPINKs的新成员,即SPINK13。同时,在皮肤肿瘤患者组织中,发现了两个SPINK13的新剪接体,即SPINK13-v2和SPINK13-v3。SPINK13的发现,可能有助于更好地理解SPINKs/KLKs调控皮肤屏障功能的途径,以及与皮肤肿瘤发生和发展的相关性。
1 材料与方法1.1 材 料脱氧核糖核酸酶Ⅰ(DNase Ⅰ)及核糖核酸酶H(RNase H)均购自德国罗氏公司; 总核糖核酸(ribonucleic acid,RNA)抽提试剂盒(TRIzolTM)、胎牛血清、青霉素及链霉素均购自美国赛默飞公司; 逆转录酶(superscript Ⅱ RNase H-reverse transcriptase)购自美国英杰生命技术有限公司; 互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)扩增试剂盒(SMARTTM RACE cDNA Amplification Kit)购自北京宝日医生物技术有限公司; 培养基(EpiLifeTM)购自德国西格玛公司。
1.2 方 法1.2.1 RNA的制备使用试剂盒提取出癌症患者皮肤组织(来自德国基尔大学医学院皮肤学研究所)中的总RNA。其他试验所需的总RNA无特别说明均购于美国英杰生命技术有限公司,所有样品均保存在-80 ℃冰箱。
1.2.2 生物信息学分析利用美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的开放阅读框查找器及保守结构域数据库对测序获得的cDNA序列的开放阅读框及保守功能结构域进行分析。通过欧洲生物信息学研究所数据库(http://www.ensembl.org)比对寻找SPINKs在其他模式动物的同源性基因; 采用欧洲核苷酸数据库(http://www.ebi.ac.uk/embl/)比对序列相似性,并用比对软件GeneDoc编辑处理; 使用信号肽预测网站(http://www.cbs.dtu.dk)判断信号肽序列; 采用蛋白结构域鉴定分析工具(http://www.smart.ox.ac.uk)分析蛋白功能单元; 利用分子进化遗传分析软件MEGA 4.0进行进化树分析。
1.2.3 细胞培养人包皮角质形成细胞按Choi等[20]的方法制备。表皮标本使用胰蛋白酶处理后,在含有体积分数为10%胎牛血清(含10 μg/μL青霉素和0.1 μg/μL链霉素)的EpiLifeTM培养基中培养。当细胞融合度达到75%时,进行细胞传代。
1.2.4 cDNA末端快速扩增技术使用TRIzolTM试剂盒从人包皮角质形成细胞中提取总RNA。取3 μg总RNA用于5'端RACE和3'端RACE第一链cDNA的合成。根据预测的外显子核苷酸序列设计基因特异性引物进行cDNA末端快速扩增技术,其中5'端RACE基因特异性引物为5'-ACACTC ATTCTGGAAAGTGTGGCCATTTGAGC-3',3'端RACE基因特异性引物为5'-CGATGTAAA ATGTATATCCCACTGGACCCTGA-3',按照操作说明进行扩增。50 μL聚合酶链式反应(polymerase chain reaction,PCR)总反应体系为:cDNA 1 μL、通用引物2 μL、特异性引物2 μL、反应缓冲液5 μL、混合型聚合酶1 μL,剩余体积使用双蒸水补足。扩增程序为:95 ℃预变性1 min; 95 ℃变性30 s,72 ℃退火延伸3 min,循环5次; 95 ℃变性30 s,70 ℃退火延伸3 min,循环5次; 95 ℃变性30 s,68 ℃退火延伸3 min,循环25次; 最后68 ℃延伸10 min。再以0.5 μL的产物作为第二轮巢氏PCR的模板进行扩增,其中5'端RACE巢氏引物为5'-GGTGCTGTCACATTGGGGCAGTCTG-3',3'端RACE巢氏引物为5'-ATGCAGACTG CCCCAATGTGACAGCA-3'。PCR扩增程序为:95 ℃预变性1 min; 95 ℃变性20 s,70 ℃退火延伸3 min,循环30次; 最后在70 ℃延伸10 min。PCR产物经凝胶电泳割胶纯化后,克隆到pGEM-T载体中并进行测序。
1.2.5 逆转录酶聚合酶链反应使用TRIzolTM试剂盒从人包皮角质形成细胞中提取总RNA。以RNA作为模板,使用逆转录酶将其反转录成cDNA用于PCR扩增。根据引物设计原则设计SPINK13特异性引物进行PCR扩增,其中SPINK13-RT-F序列为5'-CATATTCAGCCACCTCATCCAG-3',SPINK13-RT-R序列为5'-AAGCAAGTGTAGTTACTCTGGTACCC-3'。选取甘油醛-3-磷酸脱氢酶(glyceraldehyd-e-3-phosphate dehydrogenase,GAPDH)为内参基因,按照操作说明进行PCR扩增。50 μL PCR扩增的总反应体系为:cDNA 2 μL、脱氧核糖核苷三磷酸(dNTP)4 μL、引物各2 μL、反应缓冲液5 μL、混合型聚合酶1 μL,剩余体积使用双蒸水补足。PCR扩增程序为:95 ℃预变性1 min; 95 ℃变性20 s,68 ℃退火延伸45 s,循环5次; 95 ℃变性20 s,66 ℃退火20 s,68 ℃延伸45 s,循环5次; 95 ℃变性20 s,64 ℃退火45 s,68 ℃延伸45 s,循环32次。使用琼脂糖凝胶电泳分析扩增产物并进行割胶测序。
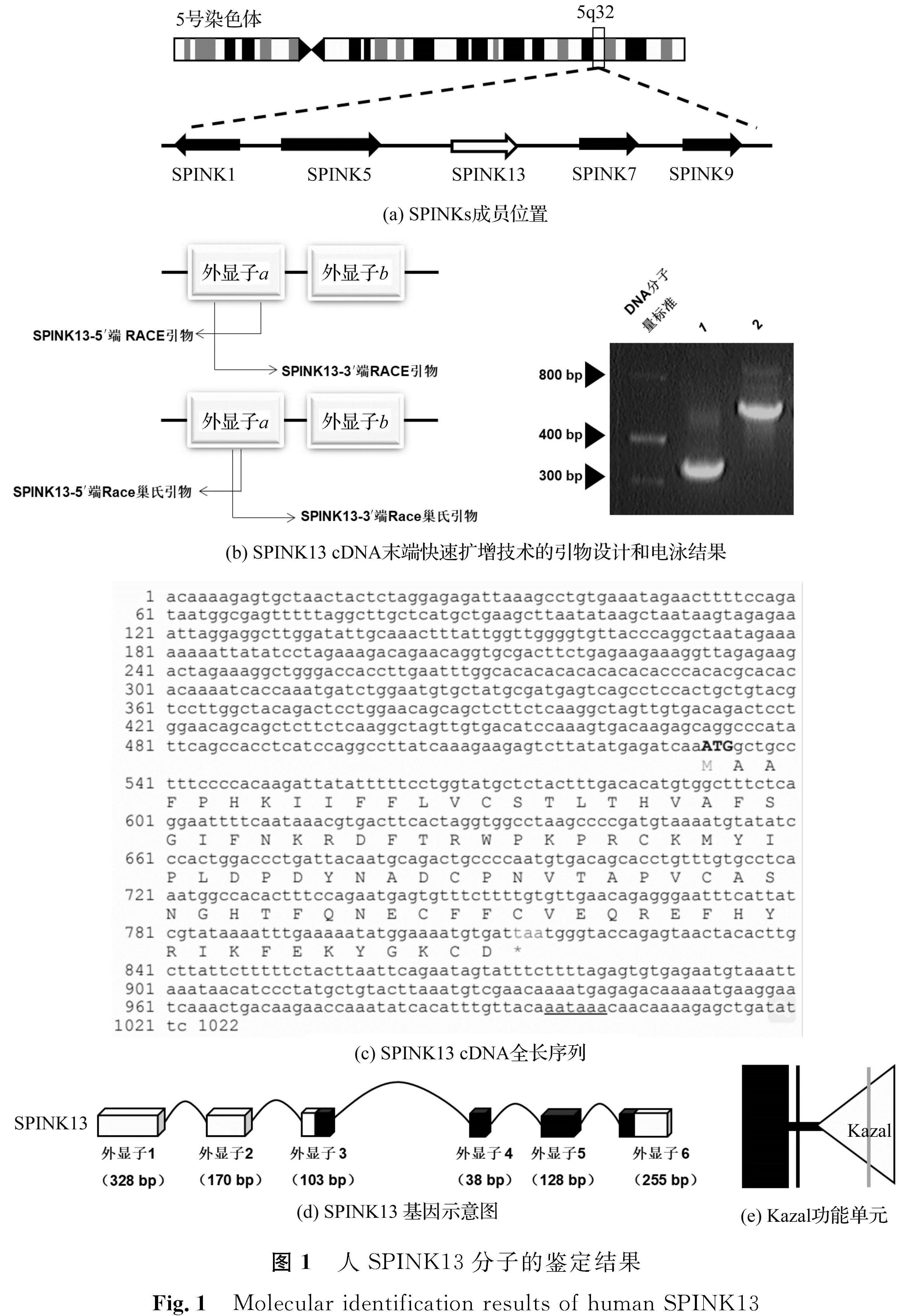
2 结果与讨论2.1 人SPINK13的cDNA全长克隆和表达分析人SPINK13分子的鉴定结果如图1所示。SPINKs位于人染色体5q32(图1(a)),为了探寻新的SPINKs成员,我们将SPINK9的功能单元Kazal序列使用tBLASTN算法在人类基因组数据中查询,以搜索潜在的同源序列。搜索结果发现,在已知基因SPINK5和SPINK7之间有一个同源序列,包含2个外显子。在数据库中提取序列并进行比对后,发现该序列与小鼠SPINK13基因高度同源,将该同源序列暂定为新基因SPINK13。
根据数据库中的序列,设计两组特异性引物(图1(b))进行cDNA末端快速扩增。在5'端RACE试验中,扩增产物的条带大小约为700碱基对(base pair,bp); 在3'端RACE的试验中,扩增产物的条带大小约为350 bp。将5'端RACE和3'端RACE结果进行对接得到SPINK13 cDNA全长序列(图1(c))。SPINK13 cDNA全长1 022 bp,其中包含一个285 bp的开放阅读框。将该序列在GenBank(核苷酸序列数据库)进行登记,获得登记号为OM275352。
将cDNA序列与基因组序列进行比对,发现SPINK13基因由6个外显子组成(图1(d)),1号外显子与2号外显子为非编码区,3号外显子至6号外显子为开放阅读框。分析SPINK13蛋白结构域发现,它由94个氨基酸残基组成,其中残基1~24为信号肽,残基4~26为跨膜结构域,残基47~93是典型Kazal域。综上所述,SPINK13编码的是包含1个典型的Kazal功能单元(图1(e))的丝氨酸蛋白酶抑制剂。
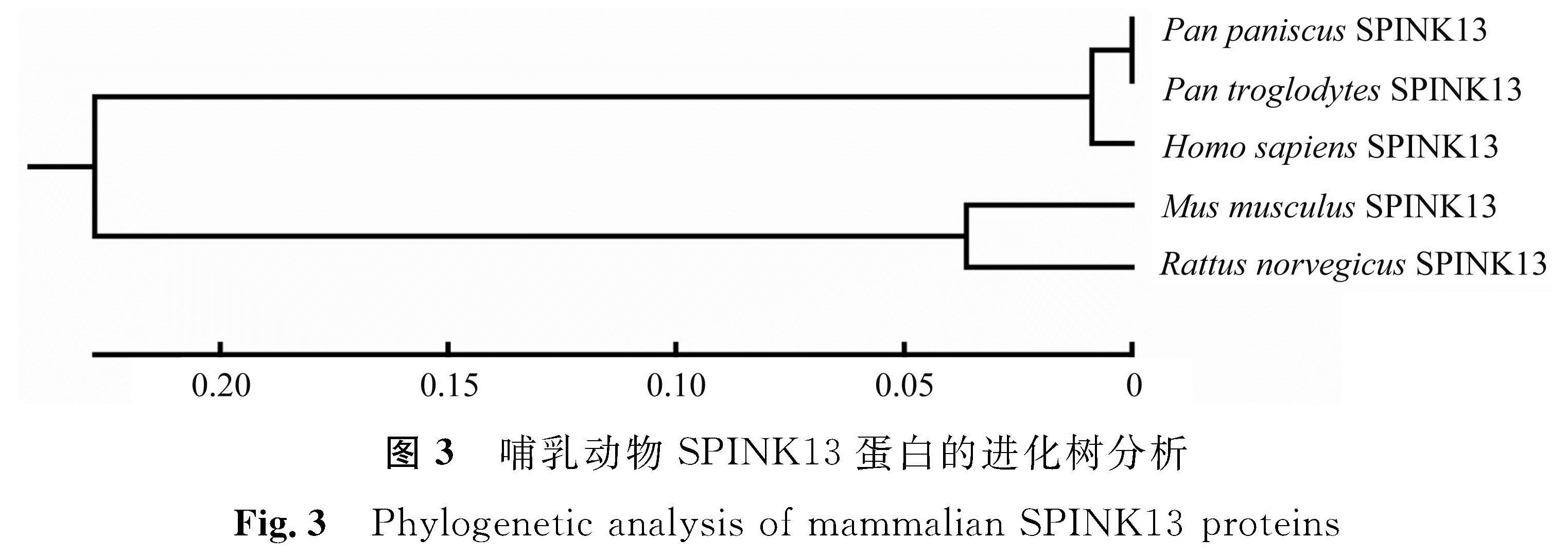
为初步判断SPINK13的蛋白功能,从蛋白数据库中提取已知的哺乳动物SPINK13的Kazal功能单元序列,进行序列比对和进化树分析。序列比对如图2所示,结果显示人(Homo sapiens)与倭黑猩猩(Pan paniscus)、黑猩猩(Pan troglodytes)、小家鼠(Mus musculus)及褐家鼠(Rattus norvegicus)的SPINK13的蛋白同源性在78%~98%,且Kazal功能单元高度保守,都具有形成3个二硫键的6个半胱氨酸残基,相邻两个半胱氨酸残基间的氨基酸残基数量也相同。哺乳动物SPINK13蛋白的进化树分析如图3所示,其结果也显示SPINK13蛋白与物种进化的一致性。这个结果表明,物种间SPINK13的蛋白功能存在保守性。
图2 哺乳动物SPINK13蛋白Kazal功能单元序列比对
Fig.2 Sequence alignment of Kazal functional units of mammalian SPINK13 protein
2.2 SPINK13在人体组织中的表达
为了探究SPINK13在人体组织中的表达情况,我们使用逆转录酶聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)进行检测,使用甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)作为内参。所得结果使用图像处理软件Image J进行灰度值分析,将分析后的灰度值使用数据处理绘图软件GraphPad Prism 7.0作图。SPINK13在人体组织中的表达如图4所示,SPINK13在肺部组织中表达丰度最高,在皮肤和结肠组织中表达丰度较低,在其他组织如脾脏、胸腺、内上皮、小肠、骨髓、嗜中性粒细胞、扁桃体、舌头、胃、支气管上皮细胞、喉、咽、鼻腔上皮细胞、淋巴、息肉、气管上皮细胞、唾液腺、肾、子宫中均未检测到其表达。SPINK13在角质形成细胞中超高丰度的表达,正说明角质形成细胞是皮肤分化过程中产生SPINK13的源泉。
与上述人SPINK13的多组织表达不同的是,Ma等[21]发现小鼠SPINK13只在附睾中特异表达,控制精子顶体的完整性和成熟度。检索基因表达数据库,人SPINK13在睾丸中高丰度表达,但在附睾中表达情况还有待证实。人与小鼠SPINK13的组织表达显著差异,可能预示着二者功能的差异。
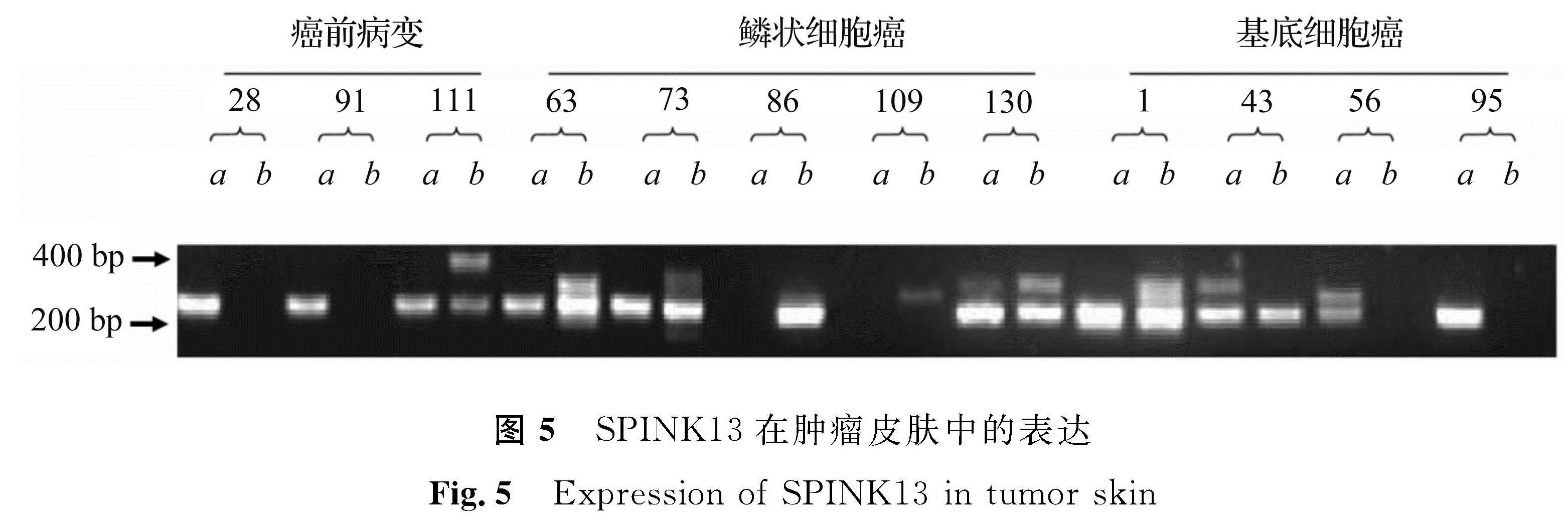
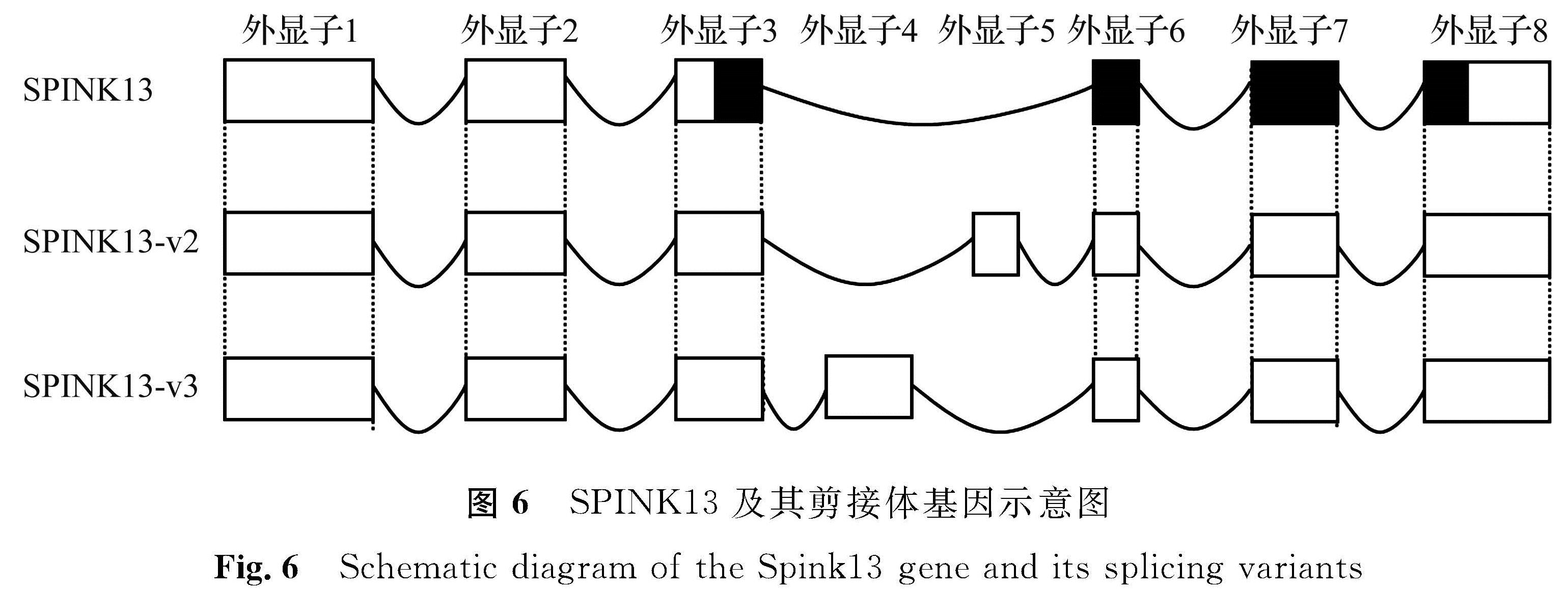
2.3 SPINK13在肿瘤皮肤中的表达为进一步了解SPINK13与皮肤分化的相关性,对一些皮肤肿瘤患者的病变组织进行RT-PCR分析。SPINK13在肿瘤皮肤中的表达如图5所示,SPINK13在癌前病变患者的健康组织a中正常表达,但在病变组织b中没有表达或出现2种转录本,一种为正常SPINK13转录本,另一种为SPINK13新剪接体SPINK13-v3(条带大小约为400 bp,在GenBank注册登记号为OM275354); 在鳞状细胞癌患者中,SPINK13在患者的健康组织a中正常表达或不表达,多数病变组织b出现3种转录本,第一种为正常SPINK13转录本,第二种为SPINK13新剪接体SPINK13-v2(条带大小约为300 bp,在GenBank注册登记号为OM275353),此外病变组织b还存在第三种与SPINK13无关的转录本(条带大小约为250 bp); 在基底细胞癌患者中,SPINK13在多数患者的健康组织a中正常表达,多数病变组织b出现不表达或出现2种转录本,即正常SPINK13转录本和新剪接体SPINK13-v2。经蛋白开放阅读框分析,两个新的剪接体都不编码蛋白,SPINK13及其剪接体基因示意图如图6。
3 结 语
本研究在皮肤角质形成细胞中发现了SPINKs的一个新成员,即SPINK13。SPINK13编码的是包含1个典型的Kazal功能单元的丝氨酸蛋白酶抑制剂。SPINK13具有组织表达特异性,在肺部组织中高度表达,在结肠和皮肤中也有表达; 角质形成细胞是皮肤产生SPINK13的源泉; SPINK13在肿瘤患者皮肤中表达异常,在癌前病变患者皮肤中表达不编码蛋白的剪接体SPINK13-v3,在鳞状细胞癌和基底细胞癌患者皮肤中表达不编码蛋白的剪接体SPINK13-v2。上述结果说明SPINK13基因与皮肤肿瘤发生发展有一定的相关性,新发现的剪接体SPINK13-v2和SPINK13-v3有望成为诊断皮肤肿瘤的标志物。
- [1] PAOLO C T D, DIAMANDIS E P, PRASSAS I. The role of kallikreins in inflammatory skin disorders and their potential as therapeutic targets[J].Critical Reviews in Clinical Laboratory Sciences,2021,58(1):13.
- [2] MELLA C, FIGUEROA C D, OTTH C, et al. Involvement of kallikrein-related peptidases in nervous system disorders[J].Frontiers in Cellular Neuroscience,2020,14(1):166.
- [3] FORTUGNO P, FURIO L, TESON M, et al. The 420K LEKTI variant alters LEKTI proteolytic activation and results in protease deregulation: implications for atopic dermatitis[J].Human Molecular Genetics,2012,21(19):4190.
- [4] KIM J, KIM M G, JEONG S H, et al. STAT3 maintains skin barrier integrity by modulating SPINK5 and KLK5 expression in keratinocytes[J].Experimental Dermatology,2022,31(2):223.
- [5] YAMAMOTO M, MIYAI M, MATSUMOTO Y, et al. Kallikrein-related peptidase-7 regulates caspase-14 maturation during keratinocyte terminal differentiation by generating an intermediate form[J].Journal of Biological Chemistry,2012,287(39):32829.
- [6] DE VEER S J, FURIO L, HARRIS J M, et al. Proteases: common culprits in human skin disorders[J].Trends in Molecular Medicine,2014,20(3):176.
- [7] WOLF W C, EVANS D M, CHAO L, et al. A synthetic tissue kallikrein inhibitor suppresses cancer cell invasiveness[J].The American Journal of Pathology,2001,159(5):1800.
- [8] BOYUKOZER F B, TANOGLU E G, OZEN M, et al. Kallikrein gene family as biomarkers for recurrent prostate cancer[J].Croatian Medical Journal,2020,61(5):453.
- [9] PRASSAS I, EISSA A, PODA G, et al. Unleashing the therapeutic potential of human kallikrein-related serine proteases[J].Nature Reviews Drug Discovery,2015,14(10):198.
- [10] RAWLINGS A V. Molecular basis for stratum corneum maturation and moisturization[J].British Journal of Dermatology,2014,171(3):19.
- [11] DESCARGUES P, DERAISON C, BONNART C, et al. Spink5-deficient mice mimic Netherton syndrome through degradation of desmoglein 1 by epidermal protease hyperactivity[J].Nature Genetics,2005,37(1):59.
- [12] CHAVANAS S, BODEMER C, ROCHAT A, et al. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome[J].Nature Genetics,2000,25(2):141.
- [13] ALVES M G, KODAMA M H, DA SILVA E Z M, et al. Relative expression of KLK5 to LEKTI is associated with aggressiveness of oral squamous cell carcinoma[J].Translational Oncology,2021,14(1):100970.
- [14] 胡榜利,利基林,谢明智.SPINK家族成员在肿瘤发病中的研究进展[J].微创医学,2019,14(2):3.
- [15] 张鼎伟,张燕飞,汪炜,等.SPINK7对IL-22介导的角质细胞异常增殖及炎症应答的影响[J].中国免疫学杂志,2021,37(1):5.
- [16] REDELFS L, FISCHER J, WEBER C, et al. The serine protease inhibitor of Kazal-type 9(SPINK9)is expressed in lichen simplex chronicus, actinic keratosis and squamous cell carcinoma[J].Archives of Dermatological Research,2016,308(2):135.
- [17] WU Z, WU Y, FISCHER J, et al. Skin-derived SPINK9 kills escherichia coli[J].Journal of Investigative Dermatology,2019,139(5):1138.
- [18] SPERRHACKE M, FISCHER J, WU Z, et al. SPINK9 stimulates metalloprotease/EGFR-dependent keratinocyte migration via purinergic receptor activation[J].Journal of Investigative Dermatology,2014,134(6):1645.
- [19] 郑戎秉,李旦,沈佳怡,等.人源SPINK6在大肠杆菌中的表达优化[J].浙江科技学院学报,2020,32(6):7.
- [20] CHOI M, PARK M, LEE S, et al. Establishment of Nrf2-deficient HaCaT and immortalized primary human foreskin keratinocytes and characterization of their responses to ROS-induced cytotoxicity[J].Toxicology in Vitro,2019,61:104602.
- [21] MA L, YU H, NI Z, et al. Spink13, an epididymis-specific gene of the Kazal-type serine protease inhibitor(SPINK)family, is essential for the acrosomal integrity and male fertility[J].Journal of Biological Chemistry,2013,288(14):10154.
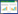 图 1 人SPINK13分子的鉴定结果
Fig.1 Molecular identification results of human SPINK13
图 1 人SPINK13分子的鉴定结果
Fig.1 Molecular identification results of human SPINK13