赤藓糖醇(erythritol)化学名为(2R,3S)-butane-1,2,3,4-丁四醇,是一种白色、无味、不吸湿、无光学活性、热稳定性好及易溶于水的四碳醇,广泛存在于水果、蔬菜和发酵食品中[1-2]。近年来,赤藓糖醇凭借其独特的理化性质如热值低、基本上不被人体代谢、稳定性高和食用不会引起肠道不适等受到广泛关注,市场需求量持续增长。据预测,到2025年,其市场需求将达到48.9万t左右[3-4]。
目前,赤藓糖醇主要由解脂亚罗酵母以葡萄糖和淀粉为原料进行发酵生产,存在生产成本高、冷却能耗大及生产效率低等问题[5]。在国家“双碳”目标背景下,实现赤藓糖醇绿色生产势在必行。其中,如何有效降低生产成本一直备受关注。高温发酵能够实现糖化和发酵过程同步进行,并且降低冷却能耗及染菌倒灌风险,是降低生产成本的重要途径[6-8]。高温发酵需要使用能够耐受热胁迫的菌株,这与解脂亚罗酵母最适生长温度(30 ℃)相悖。
适应性进化可获得耐热型菌株,然而有研究[9]表明高温胁迫可能会改变菌株的碳源利用谱。同时,在耐热型解脂亚罗酵母选育过程中,研究者发现热胁迫抑制细胞代谢合成赤藓糖醇[10]。因此,如何提高细胞在高温条件下的赤藓糖醇合成能力值得探索。本课题组前期通过适应性实验室进化结合诱变选育,已获得能够在不同温度条件下生长的解脂亚罗酵母菌株。基于已有耐热型菌株,本研究旨在探明不同碳源对这些菌株生长及产赤藓糖醇的影响; 并在此基础上,通过改变培养基中碳源组分提高赤藓糖醇产量,为今后高温发酵生产赤藓糖醇提供理论依据。
1 材料与方法1.1 材料与试剂赤藓糖醇高产菌种解脂亚罗酵母CA20由实验室选育获得,生长温度为30 ℃,现保藏于中国典型培养物保藏中心(CCTCC:M2022880)[11]2。耐热型解脂亚罗酵母HT34和HT38,生长温度分别为34 ℃和38 ℃,保藏于浙江科技学院生物与化学工程学院生物工程实验室。
试验中所用化学试剂,如无特殊说明,均为分析纯,采购于生工生物工程(上海)股份有限公司及国药集团化学试剂有限公司。大豆油脂(金龙鱼)购买于本地灵峰生活超市(浙江益海嘉里食品工业有限公司)。碳源包括单糖(葡萄糖、果糖、半乳糖、阿拉伯糖和木糖)、二糖(麦芽糖、蔗糖和纤维二糖)、糖醇(甘露醇和山梨醇)及其他物质(甘油、可溶性淀粉和大豆油脂),均购于国药集团化学试剂有限公司。
菌种活化培养基(yeast extract peptone dextrose medium,YPD):D-葡萄糖,质量浓度为20 g/L; 酵母浸出粉(oxoid),质量浓度为10 g/L; 蛋白胨(oxoid),质量浓度为5 g/L; NaCl,质量浓度为10 g/L; KH2PO4,质量浓度为0.5 g/L; 培养基溶液的pH值为6.0。固体培养基在液体培养基基础上添加质量浓度为20 g/L的琼脂粉。
试验中除碳源质量浓度变化外,其他培养基组分浓度保持不变。生长曲线测定过程中,碳源质量浓度统一为10 g/L。赤藓糖醇发酵试验中,葡萄糖质量浓度改为200 g/L。
1.2 主要仪器全波长多功能酶标仪SpectraMax iD3(美谷分子仪器(上海)有限公司)、台式高速冷冻离心机Allegra64R(美国贝克曼库尔特有限公司)、智能恒温摇床ZQZY-78AE(温度调节精度±0.1 ℃)(上海知楚仪器有限公司)、高效液相色谱仪e2695(美国沃特世公司)、Aminex HPX-87H分析柱(300 mm×7.8 mm)(美国伯乐公司)、示差折光检测器2414(美国沃特世公司)。
1.3 试验方法1.3.1 生长曲线测定将甘油管保存的菌种CA20、HT34和HT38(-80 ℃)在固体活化培养基中进行划线,之后分别置于30、34、38 ℃条件下静置培养3 d。挑取单菌落接种于5 mL YPD,200 r/min振荡培养至菌液光密度值(optical density, OD600)为3.0±0.5。之后以体积分数1%的比例转接于40 mL新鲜的待测试培养基中,分别置于30、34、38 ℃条件下,200 r/min振荡培养。培养过程中每隔24 h取样测定菌液的OD600。根据单一糖组分试验结果,测试混合碳源对不同菌株生长的影响。
1.3.2 赤藓糖醇发酵试验挑取不同菌种的单菌落于5 mL YPD中进行过夜活化培养,之后以体积分数5%的比例接种于40 mL发酵培养基中进行为期5 d的连续培养,培养温度分别为30 ℃(CA20)、34 ℃(HT34)和38 ℃(HT38),转速为200 r/min,发酵结束后取样测定发酵液中赤藓糖醇和葡萄糖的质量浓度。赤藓糖醇得率(g/g)=获得的赤藓糖醇质量/消耗的葡萄糖质量。发酵培养基中碳源为葡萄糖或葡萄糖和大豆油脂,大豆油脂质量浓度分别为10 g/L(大豆油脂1)和20 g/L(大豆油脂2)。
1.3.3 赤藓糖醇及葡萄糖检测产物和底物浓度测定采用高效液相色谱(HPLC),参照文献[11]3所述。取样后,离心收集上清液(8 000 r/min,5 min),过0.22 μm滤膜,保存于-20 ℃备用。检测条件为柱温35 ℃,进样量为10 μL,流动相是摩尔浓度为0.5 mmol/L的硫酸,流速为0.6 mL/min。
1.3.4 数据统计分析本研究中所涉及生物学试验均重复3次以上,数据差异显著性分析采用Origin 9.0软件中的ANOVA分析方法[12],选用Bonferroni多重比较,p<0.05为两组数据间差异显著。图片处理采用软件Adobe Illustrator CC 2022。
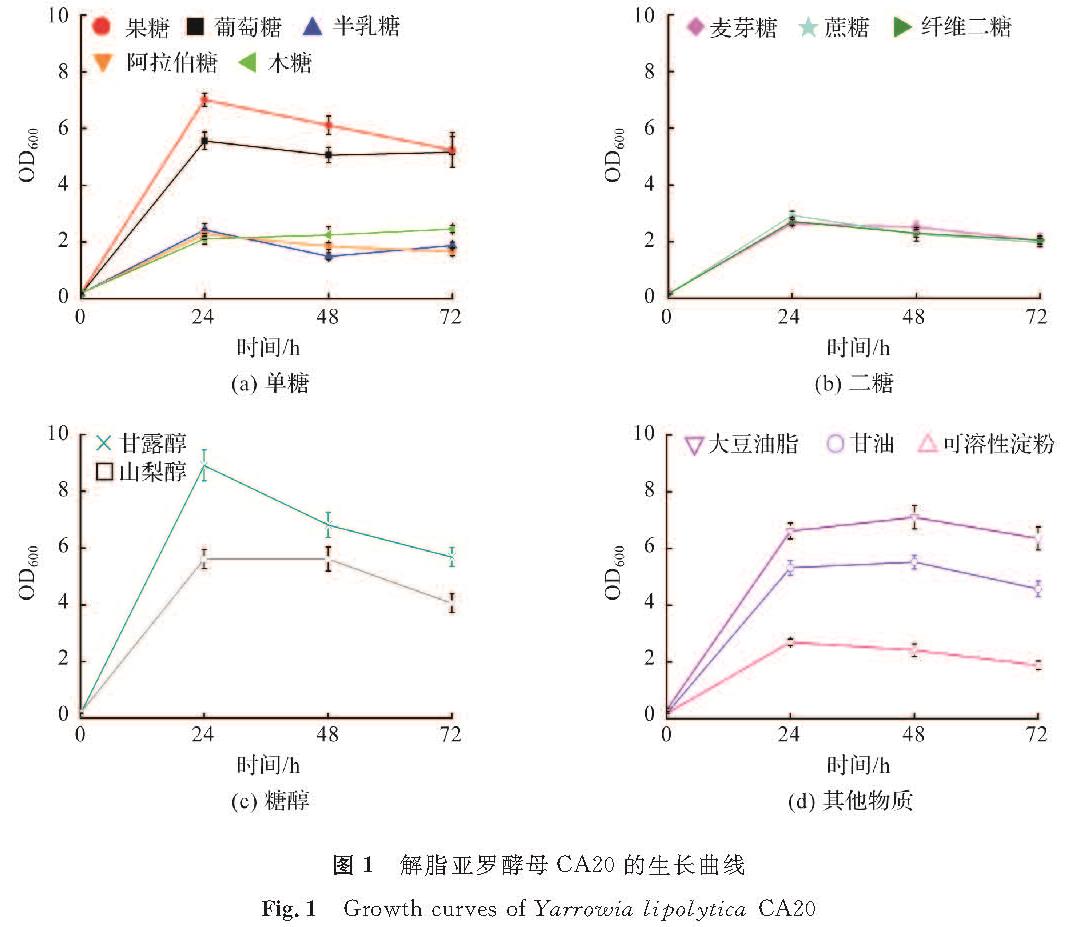
2 结果与讨论2.1 解脂亚罗酵母在单一碳源培养基中的生长解脂亚罗酵母CA20在单一碳源培养基中的生长曲线如图1所示。试验结果显示,在选取的5种单糖、3种二糖、2种糖醇和3种其他物质中,菌株CA20均能对它们进行利用。其中,相比半乳糖、阿拉伯糖和木糖等单糖,CA20更易利用果糖和葡萄糖(图1(a))。CA20在添加麦芽糖、蔗糖或纤维二糖的培养基中生长缓慢(图1(b)),说明菌株CA20对二糖的利用能力较弱。培养基中添加甘露醇可明显促进细胞的生长,而添加山梨醇时细胞的生长效果类似于在培养基中添加葡萄糖(图1(c))。此外,CA20对淀粉的利用能力较弱,细胞生长缓慢,而添加大豆油脂可明显促进其细胞生长(图1(d))。
已有研究表明,解脂亚罗酵母具有较广泛的底物谱,可利用烷烃、烯烃、有机酸、脂肪酸、甘油三酯、葡萄糖、甘油和果糖等[13]。类似地,本研究发现,解脂亚罗酵母CA20能很好地利用葡萄糖、果糖、甘露醇、山梨醇、甘油和大豆油脂进行生长。解脂亚罗酵母基因组中含有丰富的多糖水解酶编码基因,然而研究发现其并不能直接利用淀粉和纤维素等多糖,以及木糖和蔗糖[14-15]。这可能是相应酶未被激活。本研究发现,菌株CA20能部分利用木糖、蔗糖、可溶性淀粉及纤维二糖进行生长,表明不同解脂亚罗酵母间存在差异。可见,菌株CA20具有较强的工业应用潜力。
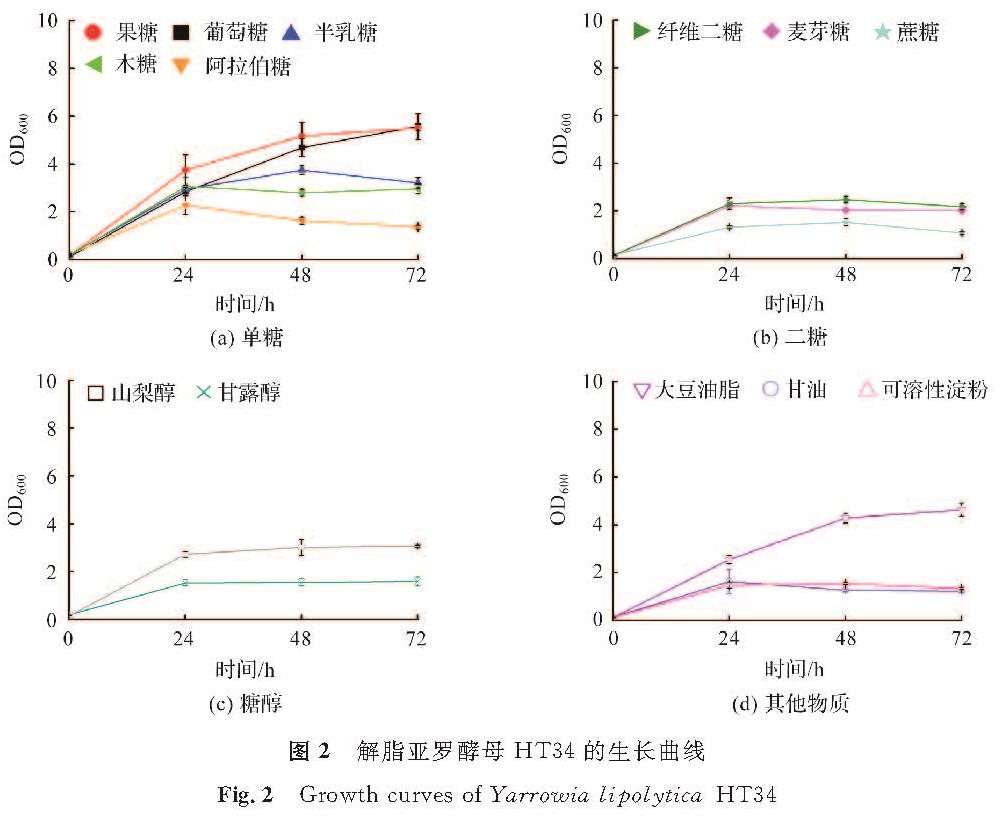
解脂亚罗酵母HT34在单一碳源培养基中的生长曲线如图2所示。试验结果显示,菌株HT34利用果糖和葡萄糖生长时,生长速率低于菌株CA20(图2(a))。菌株HT34对半乳糖和木糖的利用优于菌株CA20。在二糖利用方面,菌株HT34利用纤维二糖和麦芽糖进行生长的情况类似菌株CA20(图2(b))。此外,HT34对甘露醇和山梨醇的利用能力明显下降(图2(c))。类似现象同样出现在HT34对甘油和可溶性淀粉的利用上(图2(d))。另外,菌株HT34可利用大豆油脂进行较好的生长。菌株HT34是以解脂亚罗酵母CA20为基础,通过适应性进化选育获得的能在34 ℃条件下生长的耐热型解脂亚罗酵母。以上结果表明,经过耐热适应性进化,菌株HT34的底物利用谱发生了变化,这与已有研究结果一致[9]。
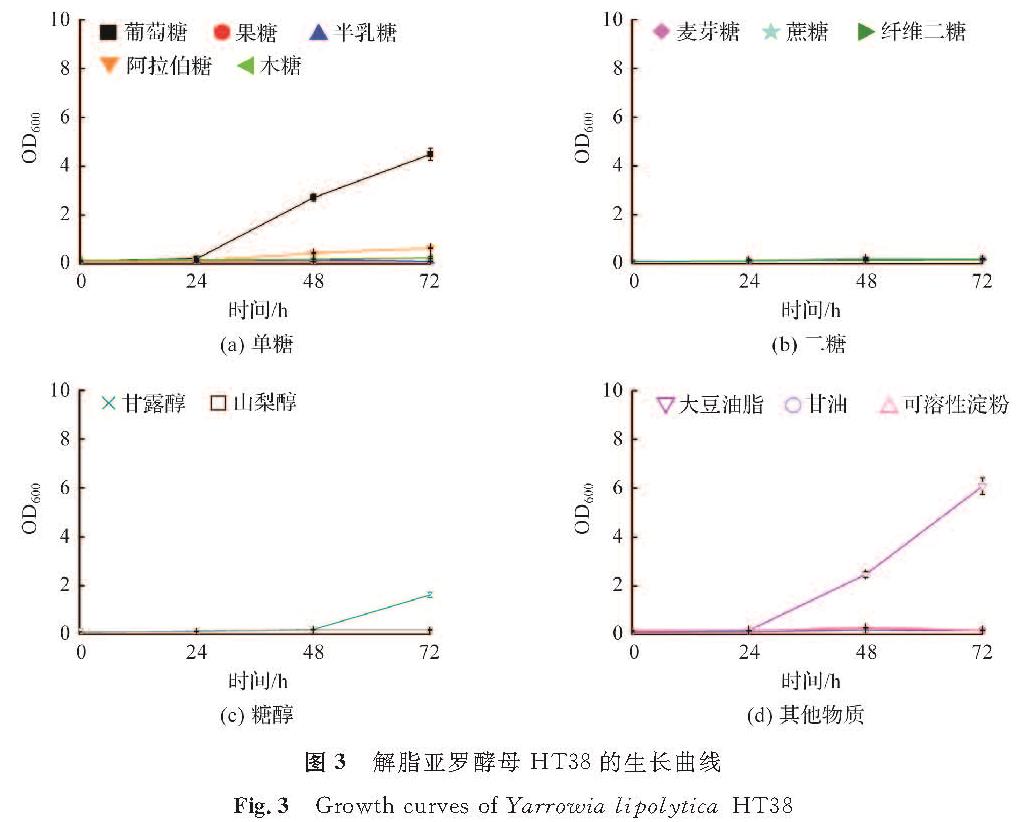
解脂亚罗酵母HT38在单一碳源培养基中的生长曲线如图3所示。试验结果显示,解脂亚罗酵母HT38不能利用除葡萄糖以外的其他单糖,同时生长存在更长的延滞期(图3(a))。对于麦芽糖、纤维二糖和蔗糖,HT38则完全不能利用(图3(b))。此外,菌株HT38同样不能利用山梨醇,而在含有甘露醇的培养基中培养延滞期高达48 h(图3(c))。类似地,菌株HT38不能利用甘油和可溶性淀粉,但可以利用大豆油脂进行较好的生长(图3(d))。
综上所述,菌株CA20在耐热适应性进化过程中碳源利用谱发生变化。随着温度的升高,细胞逐渐失去了对葡萄糖以外的单糖、二糖、糖醇及甘油和可溶性淀粉利用的能力。这可能由两方面原因导致:首先,耐热菌株选育过程以葡萄糖作为唯一碳源; 其次,热胁迫抑制了细胞中涉及其他碳源代谢酶的活性。值得注意的是,耐热型解脂亚罗酵母可利用大豆油脂进行较好的生长。
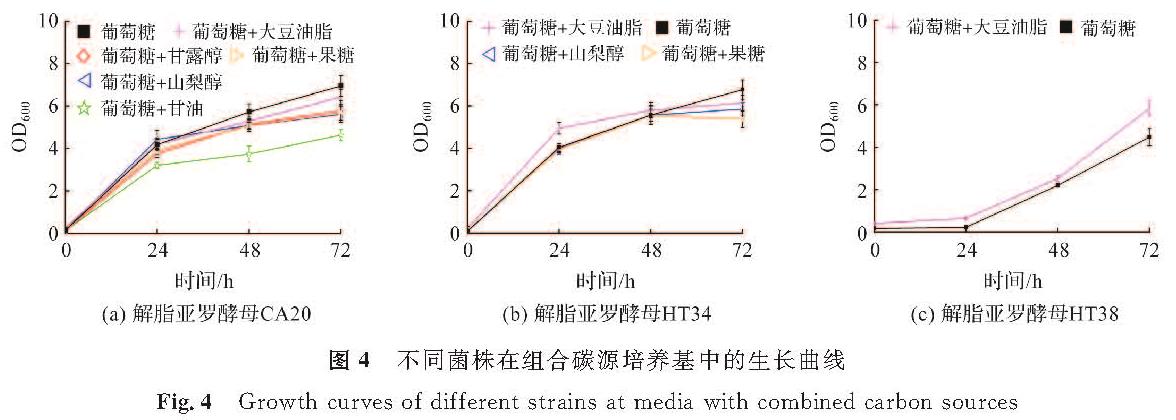
2.2 解脂亚罗酵母在混合碳源培养基中的生长组合碳源对不同菌株生长的影响如图4所示。试验结果显示,相比单独添加葡萄糖,培养基中同时添加葡萄糖和甘露醇、山梨醇或果糖对菌株CA20的生长无明显影响,而同时添加葡萄糖和甘油对CA20的生长产生抑制作用(图4(a))。对于菌株HT34,同时添加葡萄糖和山梨醇或果糖对其生长无明显影响,而添加葡萄糖和大豆油脂可促进其在48 h前的生长(图4(b))。类似地,培养基中同时添加葡萄糖和大豆油脂可促进菌株HT38的生长(图4(c))。综上可知,培养基中加入大豆油脂有利于耐热型解脂亚罗酵母的生长,这与使用单一碳源的结果类似。已有研究表明,通过改变细胞膜脂质组分提升细胞结构稳定性是酵母菌抵御热胁迫的重要策略[16]。大豆油脂中含有丰富的脂肪酸成分,因此培养基中添加大豆油脂可为细胞提供丰富的脂肪酸,进而有利于细胞在热胁迫环境中生长。
2.3 大豆油脂对耐热型解脂亚罗酵母产赤藓糖醇的影响
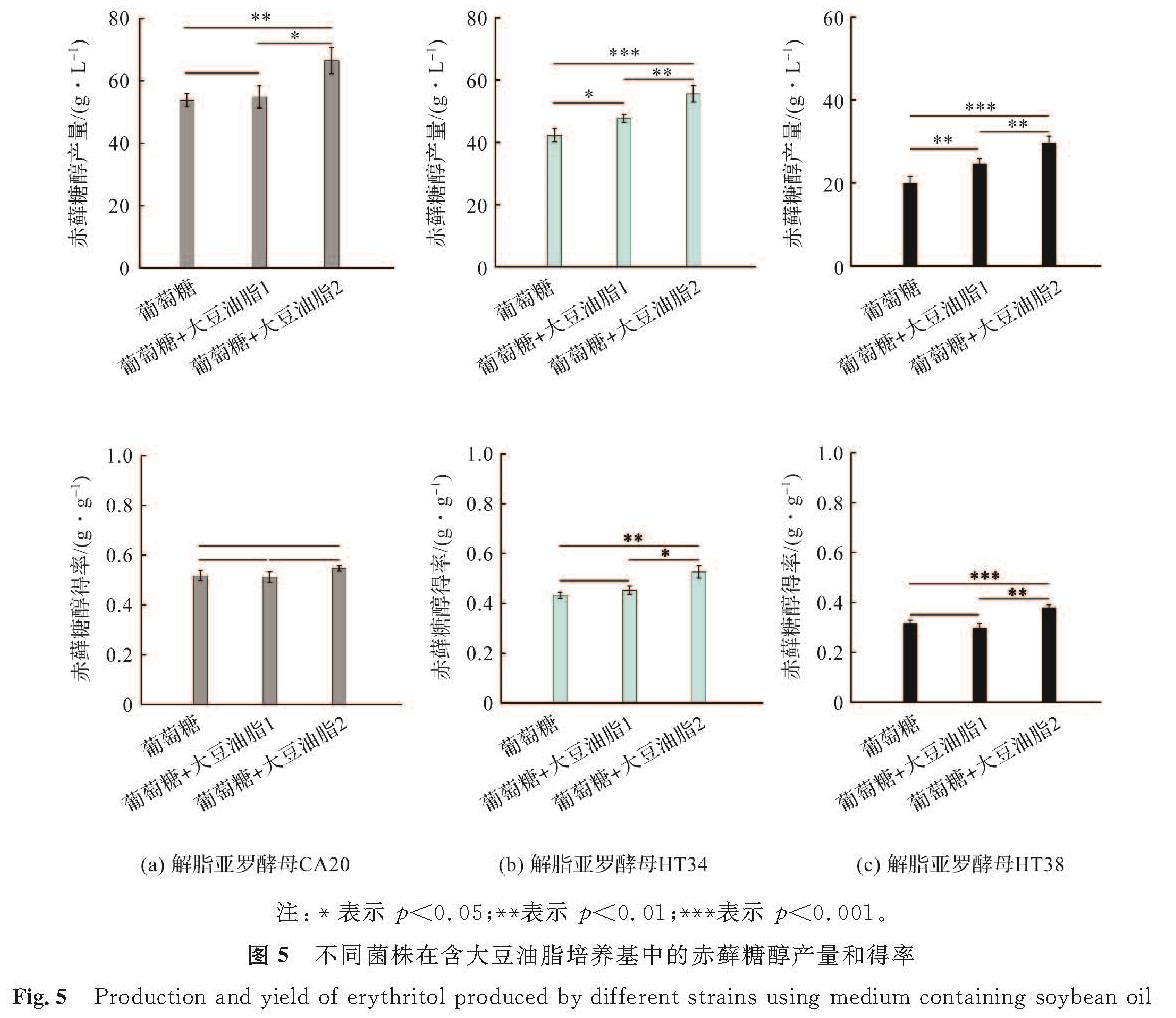
不同菌株在含大豆油脂培养基中的赤藓糖醇产量和得率如图5所示。试验结果显示,添加10 g/L大豆油脂对菌株CA20的赤藓糖醇产量无明显促进作用(p>0.05)(图5(a))。添加20 g/L大豆油脂时赤藓糖醇产量为66.52 g/L,显著高于不添加大豆油脂时的53.81 g/L和添加10 g/L大豆油脂时的54.87 g/L。在不添加大豆油脂的情况下,菌株HT34的赤藓糖醇产量为42.33 g/L,低于菌株CA20的产量,表明热胁迫抑制细胞代谢合成赤藓糖醇。这与已有的研究报道类似[17]。添加10 g/L和20 g/L的大豆油脂可显著提升菌株HT34的赤藓糖醇产量至47.67 g/L和55.67 g/L(图5(b))。类似结果同样出现在菌株HT38中,添加20 g/L的大豆油脂可提升HT38的产量至29.67 g/L,显著高于不添加大豆油脂时的20.5 g/L,产量增加比例达44.73%(图5(c))。
相比产量,添加大豆油脂并不能明显提升菌株CA20的赤藓糖醇得率(图5(a)),然而添加20 g/L的大豆油脂可显著提升菌株HT34和HT38的赤藓糖醇得率(图5(b)和(c))。添加20 g/L的大豆油脂时,菌株HT34和HT38的赤藓糖醇得率分别为0.53 g/g和0.38 g/g,显著高于未添加时的0.43 g/g和0.32 g/g,增加比例分别为23.26%和18.75%。综上可知,耐热型解脂亚罗酵母的赤藓糖醇产量和得率低于常温菌株CA20,培养基中添加大豆油脂可显著提升耐热型解脂亚罗酵母的赤藓糖醇产量。
图5 不同菌株在含大豆油脂培养基中的赤藓糖醇产量和得率
Fig.5 Production and yield of erythritol produced by different strains using medium containing soybean oil
3 结 语
本研究探索了不同碳源对耐热型解脂亚罗酵母生长及代谢合成赤藓糖醇的影响。试验结果表明,适应性进化过程中,耐热菌株逐渐失去对除葡萄糖和大豆油脂以外的单糖、二糖、糖醇及甘油和可溶性淀粉的利用能力。组合添加葡萄糖和大豆油脂可显著促进耐热菌株HT34和HT38的生长及赤藓糖醇合成,其中赤藓糖醇产量和得率的增加量最大可达44.73%和23.25%。本研究结果为今后利用高温发酵生产赤藓糖醇提供了理论依据。
- [1] ERIAN A M,SAUER M. Utilizing yeasts for the conversion of renewable feedstocks to sugar alcohols:a review[J]. Bioresource Technology,2022,346:126296.
- [2] DAZA-SERNA L,SERNA-LOAIZA S,MASI A,et al. From the culture broth to the erythritol crystals:an opportunity for circular economy[J]. Applied Microbiology and Biotechnology,2021,105(11):4467.
- [3] 中国食品科学技术学会.赤藓糖醇的科学共识[J].中国食品学报,2022,22(12):405.
- [4] LIU X Y,YU X J,HE A Y,et al. One-pot fermentation for erythritol production from distillers grains by the co-cultivation of Yarrowia lipolytica and Trichoderma reesei[J]. Bioresource Technology,2022,351:127053.
- [5] BILAL M,XU S,IQBAL H M N,et al. Yarrowia lipolytica as an emerging biotechnological chassis for functional sugars biosynthesis[J]. Critical Reviews in Food Science and Nutrition,2021,61(4):535.
- [6] LU Z L,WU Y L,CHEN Y,et al. Role of spt23 in Saccharomyces cerevisiae thermal tolerance[J]. Applied Microbiology and Biotechnology,2022,106(9/10):3691.
- [7] DEKKER W J C,ORTIZ-MERINO R A,KALJOUW A,et al. Engineering the thermotolerant industrial yeast Kluyveromyces marxianus for anaerobic growth[J]. Metabolic Engineering,2021,67:347.
- [8] LIANG P L,LI J,WANG Q H,et al. Enhancing the thermotolerance and erythritol production of Yarrowia lipolytica by introducing heat-resistant devices[J]. Frontiers in Bioengineering and Biotechnology,2023,11:1108653.
- [9] CASPETA L,CHEN Y,GHIACI P,et al. Altered sterol composition renders yeast thermotolerant[J]. Science,2014,346(6205):75.
- [10] QIU X L,GU Y,DU G C,et al. Conferring thermotolerant phenotype to wild-type Yarrowia lipolytica improves cell growth and erythritol production[J]. Biotechnology and Bioengineering,2021,118(8):3117.
- [11] 刘芳美,夏凯,彭艳婷,等.复合诱变选育高产赤藓糖醇解脂亚罗酵母及其发酵工艺优化[J].核农学报,2023,37(5):907.
- [12] XIA K,HAN C C,XU J,et al. Toxin-antitoxin HicAB regulates the formation of persister cells responsible for the acid stress resistance in Acetobacter pasteurianus[J]. Applied Microbiology and Biotechnology,2021,105(2):725.
- [13] PARK Y K,LEDESMA-AMARO R. What makes Yarrowia lipolytica well suited for industry[J]. Trends in Biotechnology,2023,41(2):242.
- [14] CELINSKA E,NICAUD J M,BIALAS W. Hydrolytic secretome engineering in Yarrowia lipolytica for consolidated bioprocessing on polysaccharide resources:review on starch,cellulose,xylan,and inulin[J]. Applied Microbiology and Biotechnology,2021,105(3):975.
- [15] RYU S,HIPP J,TRINH C T. Activating and elucidating metabolism of complex sugars in Yarrowia lipolytica[J]. Applied and Environmental Microbiology,2016,82(4):1334.
- [16] WANG L,YANG X,JIANG H Y,et al. Protein kinases Elm1 and Sak1 of Saccharomyces cerevisiae exerted different functions under high-glucose and heat shock stresses[J]. Applied Microbiology and Biotechnology,2022,106(5/6):2029.
- [17] ZHANG Y,ZHANG X Y,XU Y R,et al. Engineering thermotolerant Yarrowia lipolytica for sustainable biosynthesis of mannitol and fructooligosaccharides[J]. Biochemical Engineering Journal,2022,187:108604.
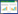 图 1 解脂亚罗酵母CA20的生长曲线
Fig.1 Growth curves of Yarrowia lipolytica CA20
图 1 解脂亚罗酵母CA20的生长曲线
Fig.1 Growth curves of Yarrowia lipolytica CA20