随着工业化和城市化的快速发展,城镇污水和工业废水排放量逐年增长,水体污染问题日益严重,其中氮素污染尤为突出[1-2]。氮素(包括有机氮、氨、亚硝酸盐、硝酸盐等)过量排放不仅会引发水体富营养化,还能导致水质恶化和生态失衡[3-5]。生物脱氮是当前主流的污水废水脱氮技术,其中硝化与厌氧氨氧化(anaerobic ammonia oxidation, ANAMMOX)是两种核心生物脱氮工艺。在硝化过程中,氨氧化菌(ammonia oxidizing bacteria,AOB)首先将氨氧化为亚硝酸盐,随后被亚硝酸盐氧化菌(nitrite oxidizing bacteria, NOB)进一步氧化为硝酸盐[6]。ANAMMOX过程由厌氧氨氧化菌(anaerobic ammonia oxidizing bacteria, AnAOB)催化,可直接将氨和亚硝酸盐转化为氮气[7]。通过控制硝化过程,使氨部分转化为亚硝酸盐,进行短程硝化(partial nitritation, PN),再与ANAMMOX过程耦合,构建短程硝化/厌氧氨氧化(partial nitritation/ANAMMOX, PN/A)工艺,实现了高效生物脱氮[8-9]。
亚硝酸盐是PN的产物和ANAMMOX的基质,有一定的亚硝酸盐积累量是PN/A工艺的关键条件,而亚硝酸盐含量过高或过低都会对PN/A工艺脱氮性能和稳定性造成严重影响[10]。因此,有必要对硝化和ANAMMOX过程进行实时监控,以维持合适的亚硝酸盐含量。当前的亚硝酸盐检测方法有色谱法、光谱法、分光光度法等,这些方法普遍存在操作复杂、响应时间长等缺点,无法用于实时反映亚硝酸盐含量的动态变化情况[11-13]。
近年来,电化学分析技术因其操作简便、响应迅速而在污染物传感领域受到了广泛关注[14-15]。尽管电化学分析技术已用于食品或天然水体中的亚硝酸盐检测[16],但鲜见用于污水废水,几乎未见用于硝化和ANAMMOX过程。亚硝酸盐的电化学信号源于其在阳极表面发生氧化反应所产生的阳极电流[17]300,信号大小不仅取决于阳极电位和亚硝酸盐含量,也受温度、pH和电导率等因素的影响[18]541,[19]。而在硝化和ANAMMOX过程中,离子的消长会引发pH和电导率明显改变,进而可能干扰阳极电流并最终影响电化学传感的准确性。
本研究采用循环伏安法(cyclic voltammetry, CV)和恒电位计时电流法(chronoamperometry, CA)对硝化和ANAMMOX废水及反应液进行测试,考察了阳极电位、CV扫描速率(ν)、亚硝酸盐质量浓度(C)、pH和电导率(κ)等因素对阳极电流的影响,探索了硝化和ANAMMOX过程亚硝酸盐的电化学传感技术,研究结果可有力促进硝化和ANAMMOX的过程控制,助力PN/A工艺的推广和应用。
1 材料和方法1.1 电极制备在抛光绒布上用Al2O3抛光粉(粒径为0.05 μm)将玻碳电极(glassy carbon electrode, GCE)(高仕睿联光电有限公司生产,φ6 mm×80 mm,内芯φ3 mm)抛光成镜面,用超纯水冲洗干净,然后在无水乙醇中超声处理15 min。GCE晾干后置于0.1 mol/L H2SO4溶液中,以Ag/AgCl电极和石墨电极(φ6 mm×165 mm)作为参比电极和对电极,在0.5~1.2 V(vs. Ag/AgCl)的电位范围内,以100 mV/s的扫描速率进行CV测试,直至出现清洁GCE表面的特征CV图。随后,用超纯水将3种电极清洗干净,晾干后置于0.1 mol/L的NaOH溶液中,将GCE的电位设为1.6 V(vs. Ag/AgCl)并保持5 min,以此活化GCE[17]301。
1.2 模拟废水CV测试模拟废水主要成分为(NH4)2SO4、NaNO2和KHCO3,另含0.01 mg/L KH2PO4、0.03 mg/L MgSO4·7H2O、0.044 mg/L CaCl2,以及1.25 mg/L微量元素溶液[20]。所用试剂均为分析纯,试验用水为超纯水。
分别配制质量浓度为0~140 mg/L的NO-2-N模拟废水,用0.1 mol/L HCl溶液和NaOH溶液调节废水pH值为6.0~9.0,用饱和KCl溶液调节废水电导率为2.0~5.0 mS/cm。于25℃恒温水浴中,分别测定不同pH和不同电导率值下各模拟废水的CV曲线。CV扫描范围为0.4~1.5 V(vs. Ag/AgCl),扫描速率为20~100 mV/s,磁力搅拌机转速为900 r/min。
1.3 模拟废水CA测试分别配制质量浓度为0~120 mg/L的NO-2-N模拟废水,调节pH值为6.0~9.0,电导率为1.0~5.0 mS/cm。将阳极电位设定为CV曲线的峰电位(Ep),在25 ℃恒温水浴和900 r/min搅拌下,对各模拟废水进行CA测试,每10 s记录一次电流值,待电化学反应进入稳定状态后,测试5 min并计算稳态电流(ICA)平均值。
将模拟废水起始电导率分别设为1.2、2.0、3.0、4.0 mS/cm,每隔60 s加入0.1 mL质量浓度为 50 mg/mL 的NO-2-N溶液(NaNO2配置),逐步提高各废水中NO-2-N的质量浓度并进行CA测试,每3 s记录一次CA电流值(Iκ)并计算其平均值。
1.4 批式硝化试验硝化活性污泥取自杭州某污水处理厂氧化沟反应池,为絮状悬浮污泥。进行批式硝化试验前,先用KHCO3缓冲溶液冲洗污泥3次,以去除残留反应液。
批式硝化试验于500 mL批式反应器中进行,反应液污泥质量浓度以挥发性悬浮固体(volatile suspended solids, VSS)计,控制在1~2 g/L,初始NH+4-N质量浓度为80、100、200 mg/L,各批次均添加足量KHCO3来提供碱度,以维持硝化过程pH稳定。反应器置于恒温水浴装置(25 ℃)中,避光并采用磁力搅拌器进行搅拌(900 r/mim)。对硝化反应液进行CA测试,每30 s记录一次Iκ值,每隔1~2 h 取样测定反应液NH+4-N、NO-2-N和NO-3-N的质量浓度并测试pH及电导率值。
1.5 批式厌氧氨氧化试验厌氧氨氧化活性污泥取自杭州某环保公司升流式厌氧污泥床反应器,为颗粒状污泥,粒径为1~2 mm。进行批式厌氧氨氧化试验前,先用KHCO3缓冲溶液冲洗污泥3次,以去除残留反应液。
批式厌氧氨氧化试验于500 mL批式反应器中进行,反应液污泥质量浓度(以VSS计)控制在500~800 mg/L之间。反应液NH+4-N初始质量浓度分别为22、60、105 mg/L,NO-2-N质量浓度分别为30、80、140 mg/L,保持NO-2-N与NH+4-N之比约为1.32,并添加适量KHCO3以维持pH稳定。试验前向反应液持续通N2 30 min以完全去除溶解氧,之后用橡胶圈密封反应器并保持厌氧条件。反应器置于恒温水浴装置(25 ℃)中,避光并采用磁力搅拌器进行搅拌(900 r/min)。对厌氧氨氧化反应液进行CA测试,每30 s记录一次Iκ值,每隔1~2 h取样测定反应液NH+4-N、NO-2-N和NO-3-N质量浓度并测试pH及电导率值。
1.6 测定项目与方法CV和CA测试,Auto-lab电化学工作站; pH值,雷磁pHs-25型酸度计; 温度,OMRON水银温度计; 电导率,METTLER TOLEDO Five Easy实验室电导率仪; NH+4-N、NO-2-N和NO-3-N均采用标准方法测定[21]。
2 结果与讨论2.1 模拟废水CV测试2.1.1 模拟废水的CV测试曲线所有模拟废水CV测试曲线均未见还原峰(故不展示),模拟废水的CV测试曲线如图1所示。由图1(a)可知,当模拟废水中不含NO-2-N时,CV曲线无明显氧化峰,但当NO-2-N质量浓度为10~140 mg/L时(电导率恒定为3 mS/cm),均可见明显氧化峰,峰电位(Ep)集中在0.70~0.75 V(vs. Ag/AgCl),且随NO-2-N质量浓度的增加而正移; 此外,随着NO-2-N质量浓度的逐步增大,氧化峰电流(Ip)由0.005 2 mA升至0.151 3 mA。据文献[18]542和[22]报道,由于GCE表面电子转移速率不高,其电化学活性较弱,通常需在0.9~1.2 V(vs. Ag/AgCl)阳极电位下才能出现一弱氧化峰。相比之下,在经过表面活化处理后,GCE的电荷传递能力明显提升,可在更低的Ep下产生氧化峰。NO-2在GCE表面的电化学反应式[23]为:

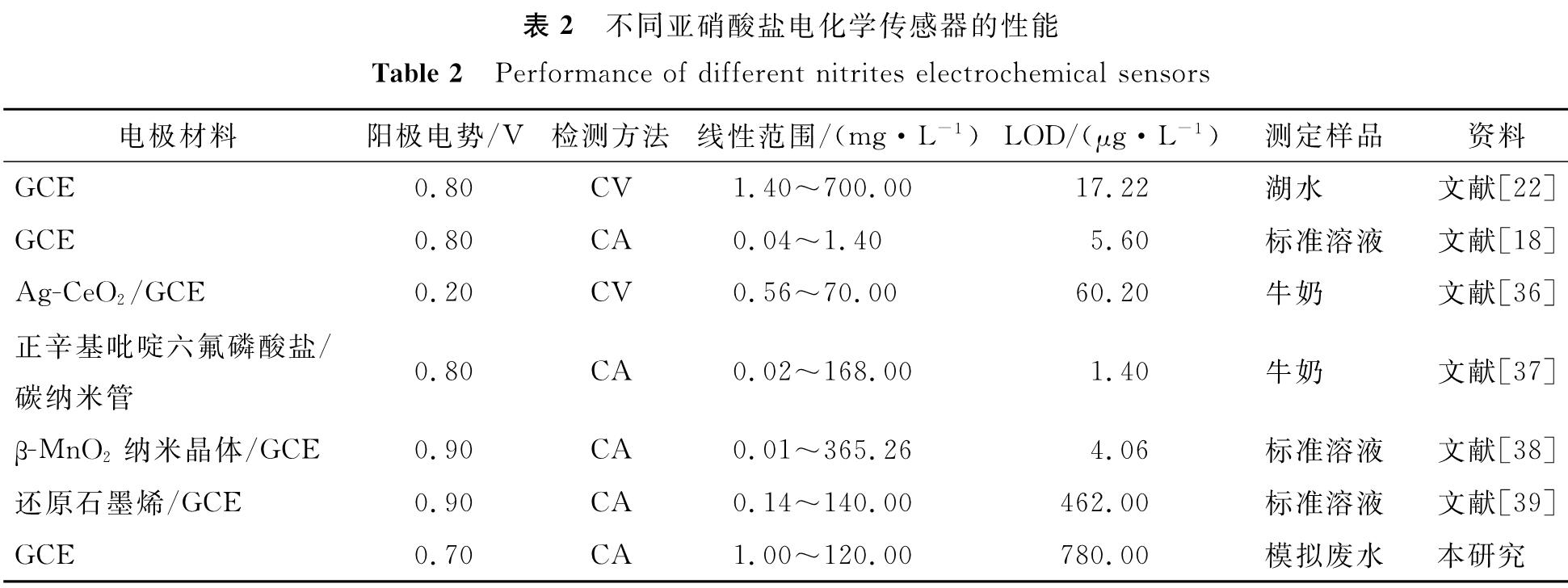
其中,式(1)为限速步骤,因此阳极电流主要由NO-2质量浓度和电极表面电化学催化活性决定。本试验的活化GCE所测Ip与NO-2-N质量浓度(10~120 mg/L)呈现良好的线性关系,相关性系数均大于0.99。然而,基于3倍信噪比进行计算,GCE的NO-2-N检出限(limit of detection,LOD)为5.70 mg/L,灵敏度为8.21×10-3 A/(mol·L-1),检出限和灵敏度都弱于文献[24-25]报道的修饰电极。综上可知,在CV测试中GCE具有较宽的线性响应范围,但其检出限和灵敏度均不太理想。
以不同扫描速率(20~100 mV/s)对质量浓度为80 mg/L的NO-2-N模拟废水(电导率为3.0 mS/cm)进行CV测试,结果显示Ip与ν1/2成正相关(图1(b)),两者拟合关系式为Ip=0.249 2ν1/2+0.065 1(R2=0.998),说明NO-2在GCE电极表面的电化学氧化速率受扩散控制。据文献[26]报道,扩散控制下,Ip与ν关系可表示为:

式(3)中:A为电极面积,cm2; CM为NO-2-N摩尔浓度,mmol/L; z为反应速率控制步骤中转移的电子数,由式(1)可知z=1; D为扩散系数,cm2/s。本试验中,已知A为0.071 cm2,CM为5.71 mmol/L,计算可得D=5.2×10-6 cm2/s,接近文献[18]543和[19,27]报道的2×10-6~2×10-5 cm2/s范围。
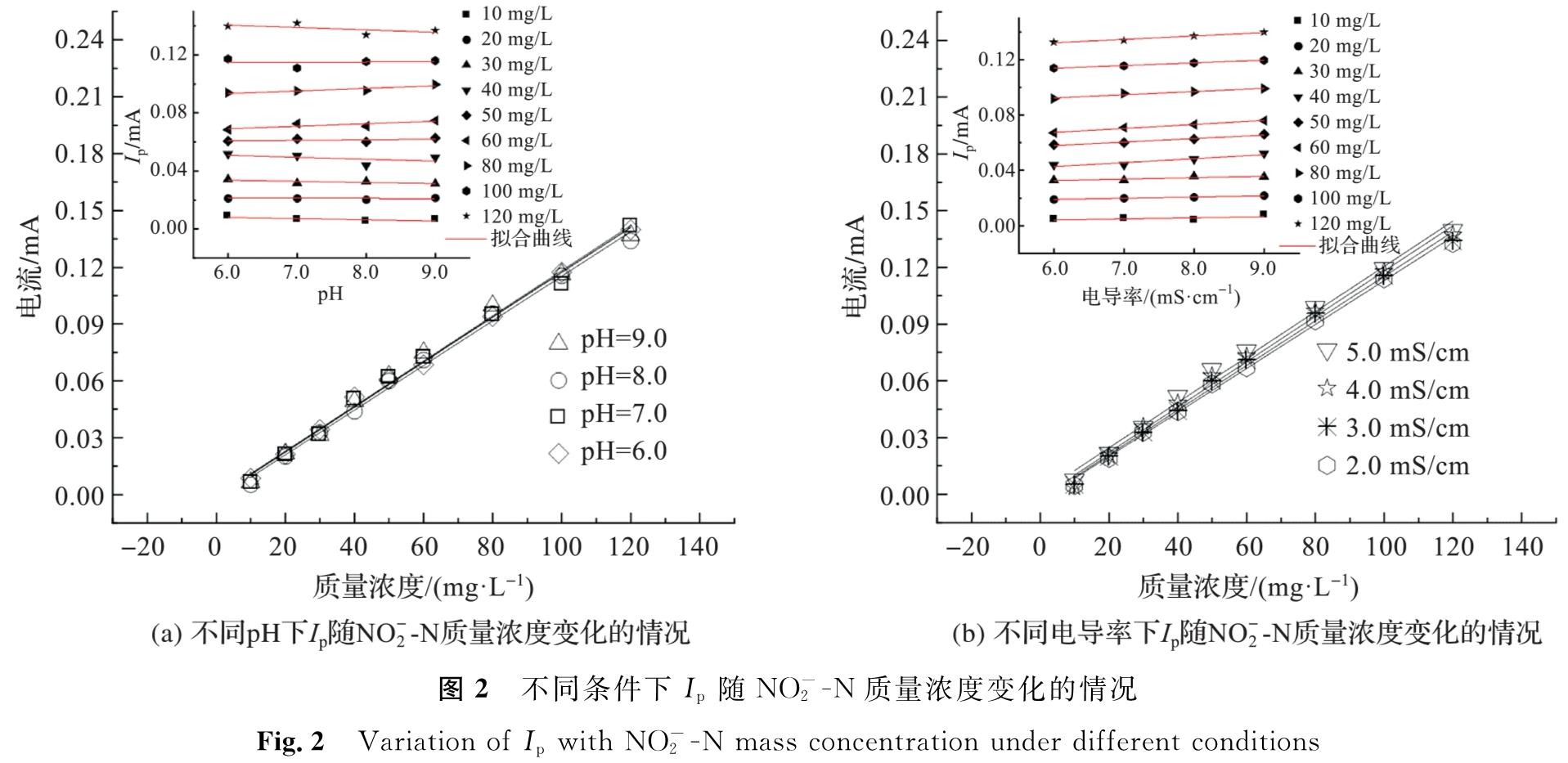
2.1.2 pH和电导率对CV峰电流的影响为了探究pH和电导率对Ip的影响,在不同pH值(6.0~9.0)和电导率(2.0~5.0 mS/cm)条件下进行CV测试。不同条件下Ip随NO-2-N质量浓度的变化情况如图2所示,各pH下(图2(a)),Ip与NO-2-N质量浓度均有良好的线性关系(R2>0.998),且线性关系曲线斜率较为接近(约为0.001 2)。各NO-2-N质量浓度下,Ip与pH线性相关性较弱(R2>0.502),随着pH值的增加,Ip有所波动,但每改变1单位pH值,Ip平均变化量均小于3.0%,Ep有所正移,但不超过0.8 V。由于HNO2的解离常数(Ka)为5.1×10-4(pKa=-lgKa=3.29),一旦pH值高于pKa,HNO2就会加速向NO-2转化,而当pH值达6.0~9.0时,模拟废水中的亚硝酸盐主要以NO-2的形式存在,pH值变化对亚硝酸盐解离平衡影响较小,因此不会显著改变NO-2质量浓度和对应的Ip值[18]541。
模拟废水电导率对Ip的影响如图2(b)所示。在不同电导率条件下,Ip与NO-2-N质量浓度均具有良好的线性相关性(R2>0.998)。各NO-2-N质量浓度下,Ip与电导率也具有较好的线性相关性(R2>0.903),Ip均随电导率的升高而增大,但电导率平均每升高1 mS/cm,Ip仅增加0.001 mA,其平均增率为4.1%; 电导率变化对Ip的改变量也较小,远不如NO-2-N质量浓度变化所带来的影响。
综上所述,在CV测试中,Ip与NO-2-N质量浓度具有较好的线性关系,pH和电导率变化不会明显改变Ip值大小,通过Ip能较好地反映模拟废水实际NO-2-N质量浓度。
图2 不同条件下Ip随NO-2-N质量浓度变化的情况
Fig.2 Variation of Ip with NO-2-N mass concentration under different conditions
2.2 模拟废水CA测试2.2.1 CA稳态电流与亚硝酸盐质量浓度及电导率的关系
尽管通过CV法可较为准确地反映模拟废水NO-2-N质量浓度,但单次CV测试用时较长(约20 min),难以实时反映NO-2-N质量浓度变化过程,而采用CA法则能弥补该不足。由CV测试可知,NO-2氧化速率在0.70~0.75 V(vs. Ag/AgCl)左右达到峰值,说明此时电极催化性能最佳,电信号最强,因此选择0.70 V(vs. Ag/AgCl)作为阳极电势,进行CA测试。
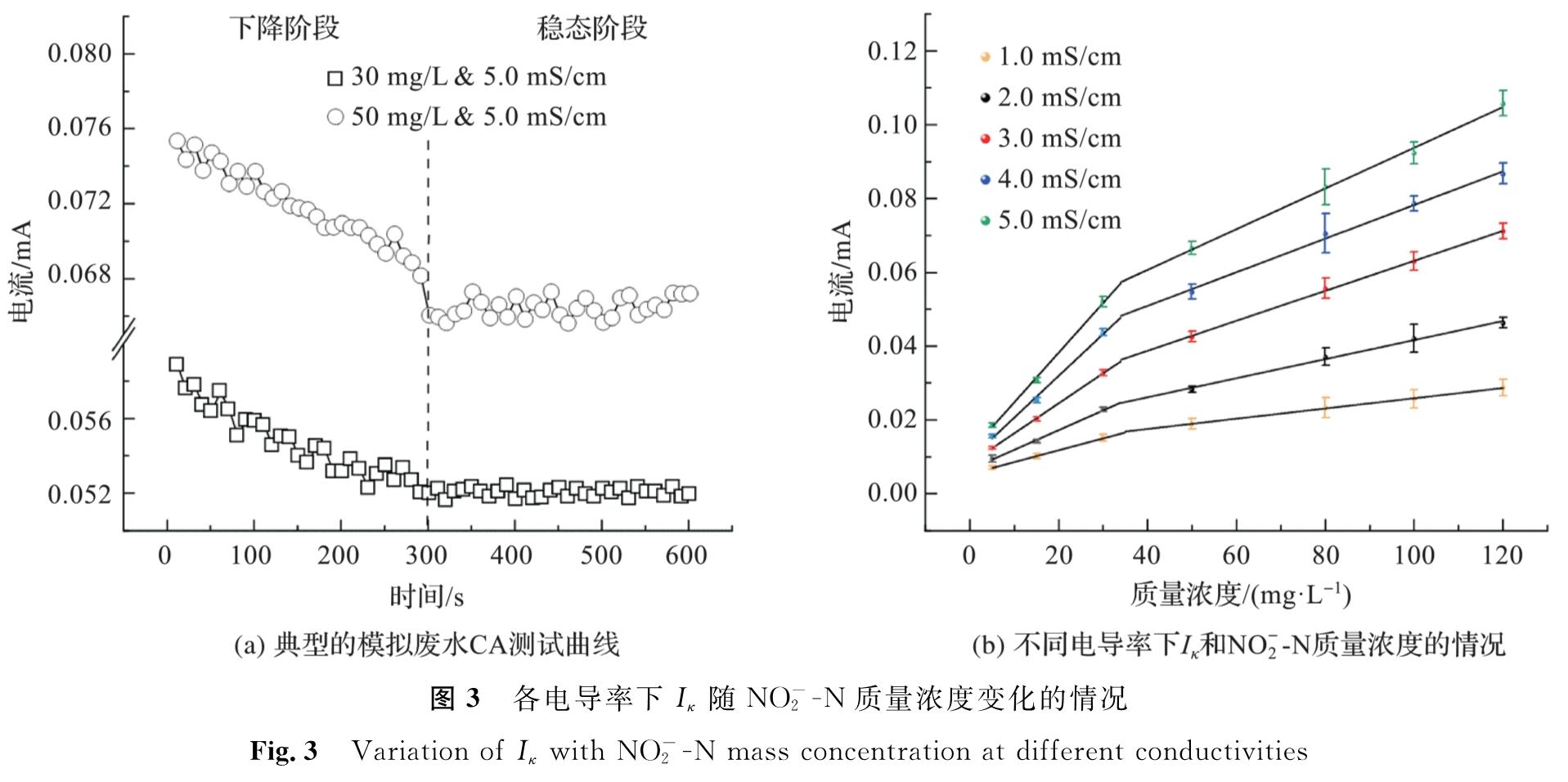
将模拟废水电导率设置为不同值进行CA测试,所得各批式试验的Iκ呈相似变化趋势(图3(a))。受离子迁移和对流的影响,Iκ先快速下降,约300 s进入稳态后基本上维持不变。经线性拟合发现,稳态阶段Iκ随NO-2-N质量浓度升高而增大(图3(b)),Iκ-C曲线分别在1~34、35~120 mg/L两个区间具有良好的线性关系(R2>0.990),其关系式可表示为

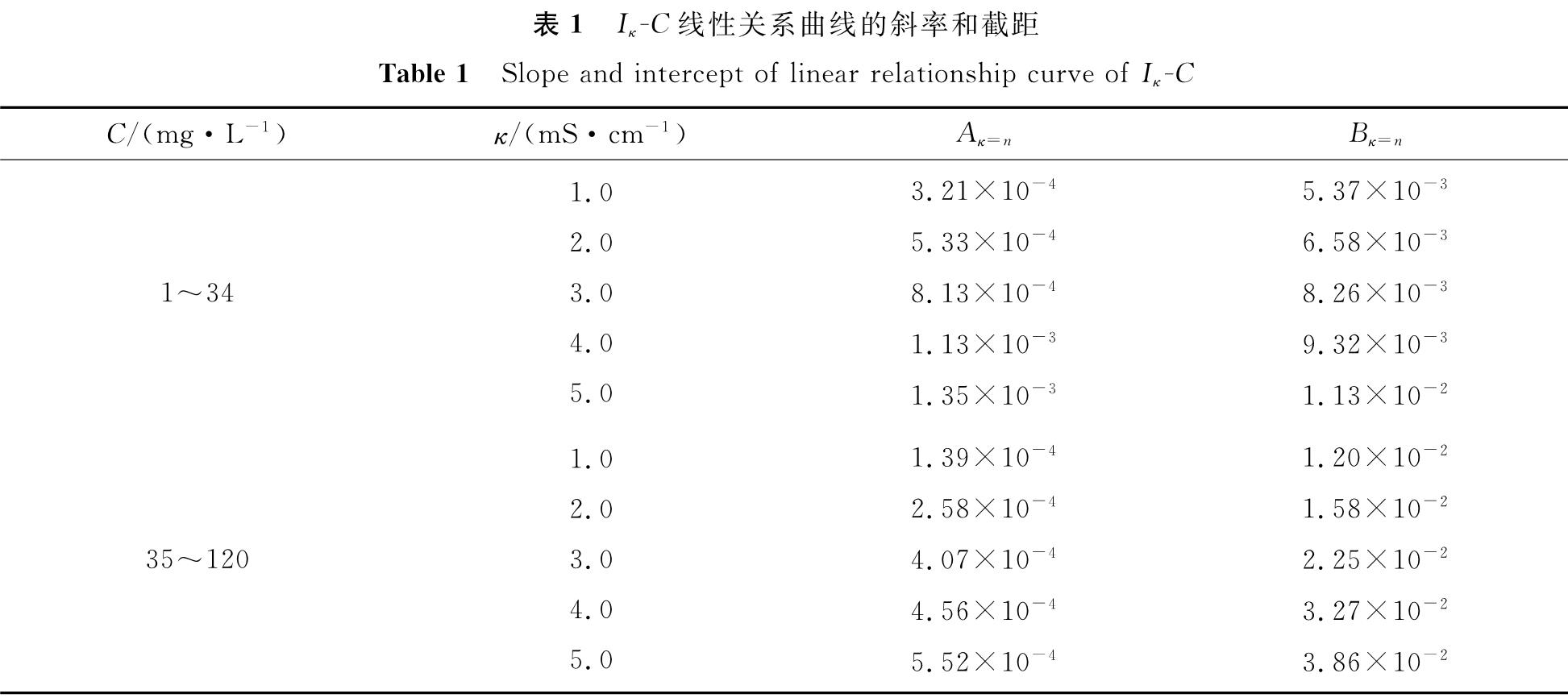
式(4)中:n为某一基准电导率值,mS/cm; Aκ=n、Bκ=n为方程的斜率和截距,其取值见表1。
由拟合结果可知低质量浓度条件下拟合曲线斜率明显较大,说明其灵敏度较高。Aκ=n的差异是由不同质量浓度NO-2-N在电极表面的电化学活性差异所致。在NO-2-N质量浓度较低时,电极表面有大量活性位点,此时NO-2-N比氧化速率较高,Aκ=n也较大; 而当NO-2-N质量浓度较高时,由于电极表面活性位点减少,NO-2比氧化速率降低,Aκ=n也随之减小[28]。另外,高质量浓度NO-2-N下灵敏度的降低也可能是由电极表面传质动力学限制所致。经3倍信噪比进行计算,5种电导率下测定的LOD分别为0.78、0.84、0.65、0.89、0.99 mg/L。尽管LOD较自然水体亚硝酸盐质量浓度(1.4~8.4 μg/L)偏高[29],但考虑到硝化和ANAMMOX过程中基质亚硝酸盐质量浓度也普遍较高,采用Iκ仍可较为准确地反映其含量变化。
图3 各电导率下Iκ随NO-2-N质量浓度变化的情况
Fig.3 Variation of Iκ with NO-2-N mass concentration at different conductivities
表1 Iκ-C线性关系曲线的斜率和截距
Table 1 Slope and intercept of linear relationship curve of Iκ-C
由图3可知,相同的NO-2-N质量浓度条件下,随着模拟废水电导率的增加,Iκ明显增大。CA测试的稳态阶段,体系中的CA电流各处相等,而在模拟废水主体溶液中,CA电流由离子迁移和对流所决定[30],即:
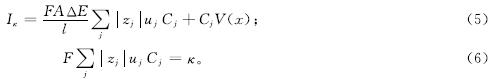
式(5)和式(6)中:l为阴阳两极距离,cm; ΔE为阴阳两极电势差,V; Cj为物质j的摩尔浓度,mmol/L; zj为物质j转移的电子个数; uj为物质j的淌度,cm2/(V·s); V(x)为溶液的对流速度,cm/s; κ为溶液电导率,mS/cm; F为法拉第常数,C/mol。
令

则式(5)可简化为

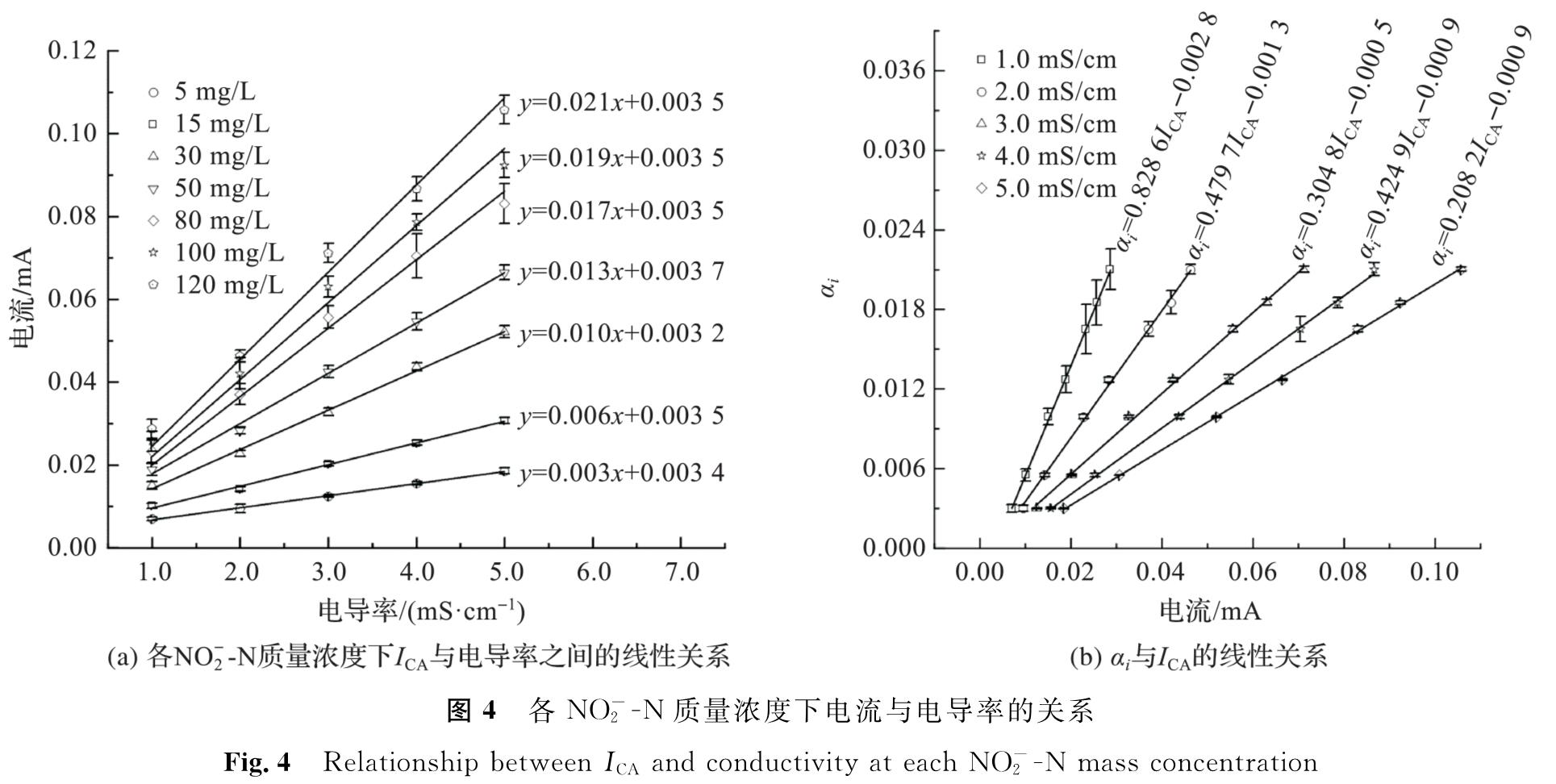
用式(8)对各NO-2-N质量浓度条件下的ICA与κ实测值进行拟合(R2>0.993),可得αi和CjV(x)值(图4(a))。由拟合结果可知,随着Iκ增大,αi逐渐变大,CjV(x)则基本上不变,约为0.003 5,由此式(8)可推广为

因为A与l均为常数,由式(7)可知,αi值由ΔE决定。而在稳态条件下,ΔE与电流呈线性相关,αi又可表示为

式(10)中:γκ=n、ηκ=n为基准电导率为n时线性方程的斜率和截距。
用式(10)对图4(a)中各αi值和各电导率下的ICA值进行拟合,发现相关性都较高(R2>0.991)(图4(b)),说明式(10)与实测数据相符。
将式(9)和式(10)联立并移项可得:

再结合式(4)和式(11),整理得:
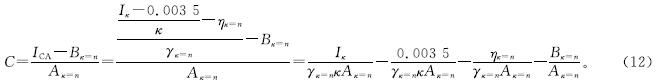
由式(12)可知,在试验已求得Aκ=n、Bκ=n、γκ=n、ηκ=n的基础上,通过实测的κ和Iκ,便可实时反映模拟废水的NO-2-N质量浓度变化。
用式(12)对图3数据进行校核,发现以基准电导率为5.0 mS/cm(n=5)时的Aκ=5、Bκ=5、γκ=5、ηκ=5进行计算,所求得的NO-2-N质量浓度与实测值最为接近,误差最小(5.53±0.5%)。因此将γκ=5=0.208 2、ηκ=5=-0.000 9,Aκ=5分别为1.35×10-3、5.52×10-4,Bκ=5分别为1.13×10-2、3.86×10-2,代入式(12),可得:
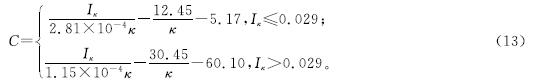
图4 各NO-2-N质量浓度下电流与电导率的关系
Fig.4 Relationship between ICA and conductivity at each NO-2-N mass concentration
2.2.2 模拟废水亚硝酸盐质量浓度的电化学传感
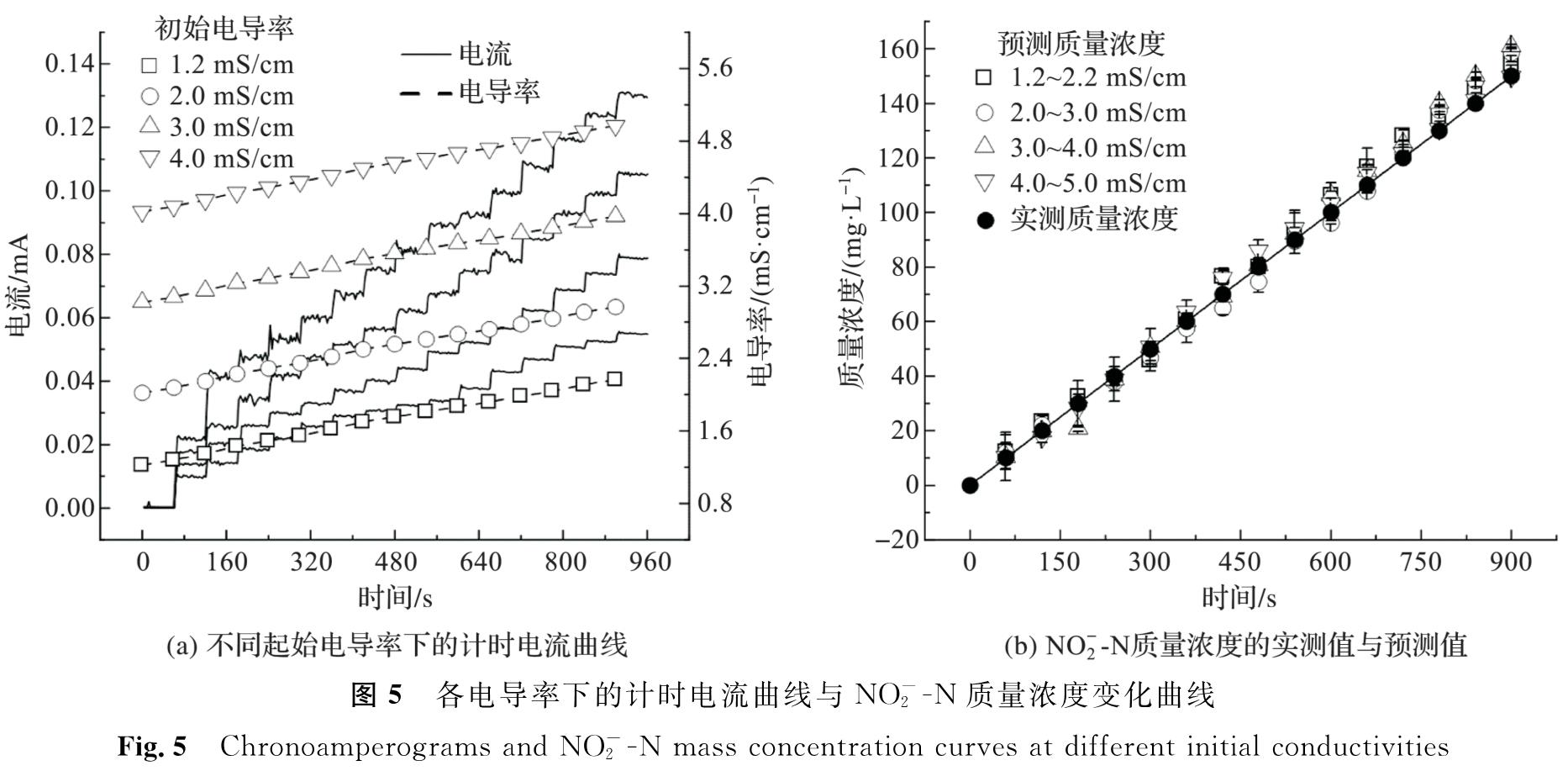
将模拟废水起始电导率分别设为1.2、2.0、3.0、4.0 mS/cm(起始NO-2-N质量浓度为0 mg/L),以模拟不同水平的无机盐质量浓度; 在此基础上,每隔60 s加入0.1 mL质量浓度为50 mg/mL的NO-2-N溶液,以模拟NO-2-N质量浓度变化,结果如图5所示。对以上模拟废水进行CA测试,所得Iκ和κ如图5(a)所示。当模拟废水中NO-2-N质量浓度为0 mg/L时,不管起始电导率为何值,Iκ都接近为0 mA; 随着NO-2-N溶液的添加,Iκ和κ同时增高并在约20 s内趋于稳定,说明Iκ和κ对NO-2-N质量浓度的变化具有较快的响应速度。不同起始电导率下,随着NO-2-N溶液的逐步添加,模拟废水Iκ和κ都随时间t呈线性增大,各κ-t曲线基本平行,而各Iκ-t曲线斜率随初始电导率增加而增大。将各模拟废水的Iκ和κ代入式(13),求得NO-2-N质量浓度,并将其与实测值进行比较(图5(b)),所得较优的检出区间为1~120 mg/L,LOD为0.78 mg/L。尽管LOD不如已报道的亚硝酸盐电化学传感器(表2),但其检出区间基本上适用于硝化和厌氧氨氧化过程常见质量浓度亚硝酸盐的检测[31-32]。此外,不同初始电导率下预测值和实测值的相对误差分别为(7.37±0.74%)、(6.52±0.61%)、(6.23±0.61%)、(6.08±0.61%)。常见电化学传感器的允许检测误差通常小于等于10%[33-34],而文献[22,35-37]报道的亚硝酸盐电化学传感器检测误差一般小于等于5%,但这些研究通常对样品进行异位检测,测定前还需要对样品进行预处理(如调节pH、添加pH缓冲溶液及大量支持电解质)以提高传感的准确性。由于本试验旨在研究硝化和厌氧氨氧化过程亚硝酸盐含量的原位实时传感,无法对模拟废水整体进行预处理,尽管传感误差略高于5%,但并未超出限值(10%),因此,以Iκ和κ作为传感信号,仍可较为准确地反映模拟废水的NO-2-N质量浓度变化。
图5 各电导率下的计时电流曲线与NO-2-N质量浓度变化曲线
Fig.5 Chronoamperograms and NO-2-N mass concentration curves at different initial conductivities
3.3 硝化过程亚硝酸盐质量浓度的电化学传感
硝化过程中,亚硝酸盐既是氨氧化的产物又是亚硝酸盐氧化的反应物,因此,其含量变化能一定程度上反映硝化动态进程。由式(14)可知,氨氧化反应将NH+4转化为NO-2,同时产酸并消耗碱度[40]373,会导致反应液电导率明显减小。
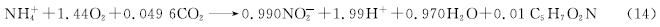
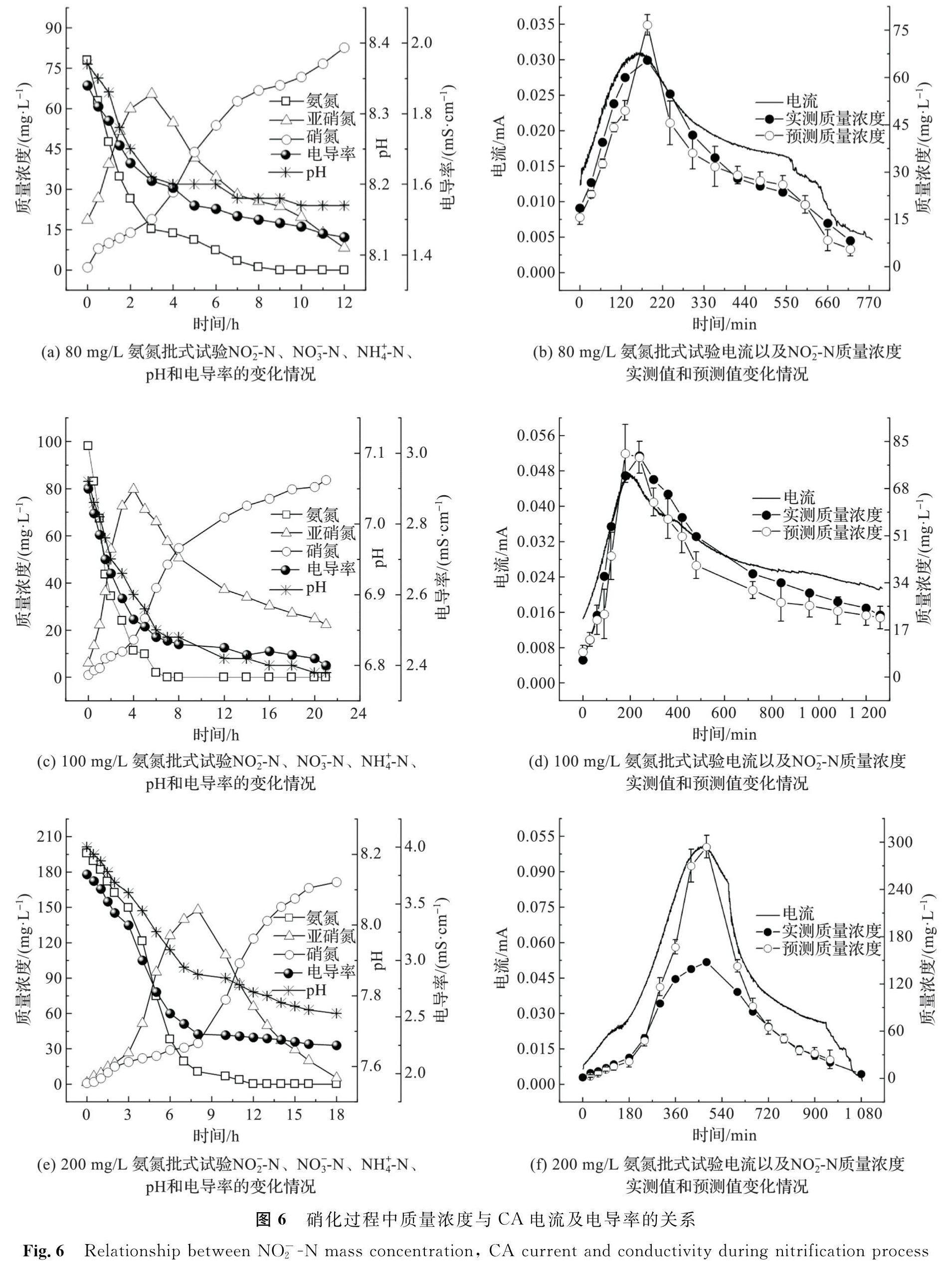
硝化过程中NO-2-N质量浓度与CA电流及电导率的关系如图6所示。由图6(a)、(c)、(e)可知,NH+4-N初始质量浓度分别为80、100、200 mg/L时,硝化反应经历了相似的过程。试验前期(0~3 h、0~4 h、0~8 h),氨氧化速率较快,分别为11.77、17.65、25.21 mg/(L·h),氨氧化率均超过80%; 试验后期(3~12 h、4~21 h、8~18 h),随着氨质量浓度降低,氨氧化速率也逐渐变慢,至试验结束,NH+4-N质量浓度缓慢降至为0。NO-2-N初始质量浓度分别为18.57、6.14、1.39 mg/L,试验开始后先逐步上升再逐步下降,分别在第3、4、8 h时达到峰值(46.86、73.63、146.44 mg/L),至试验结束再分别降至8.26、22.38、5.57 mg/L。NO-3-N初始质量浓度约为0 mg/L,至试验结束时,分别升至18.13、25.47、35.31 mg/L。由于KHCO3含量较高,碱度充足,反应液pH相对稳定,3个批式试验过程中其变化幅度分别不超过0.21、0.34、0.42。电导率变化与氨氧化过程具有较强相关性,在试验前期,氨氧化速率较高,κ分别由1.88、2.90、3.76 mS/cm快速降至1.53、2.45、2.35 mS/cm,在试验后期,随着氨氧化速率变慢,κ变化也减慢,至试验结束时分别稳定在1.45、2.40、2.25 mS/cm。
CA测试的Iκ-t曲线如图6(b)、(d)、(f)所示,试验前期,随着NO-2-N质量浓度分别由初始值增至峰值,电流同步从0.014、0.015、0.009 mA增至峰值0.030、0.045、0.099 mA; 试验后期,随着NO-2-N质量浓度逐步降低,电流也同步降至0.006、0.021、0.003 mA。电流的变化过程和NO-2质量浓度的变化过程具有较高的同步性,通过电流值可实时反映硝化反应动态进程。
将测得的电流值和电导率值代入式(13),可得NO-2-N质量浓度预测值(图6(b)、(d)、(f))。将NO-2-N预测值与实测值进行比较,结果发现:当NO-2-N为5~120 mg/L时,预测值误差分别为(17.96±1.33%)、(15.31±1.01%)、(15.17±1.21%); 当NO-2-N低至5 mg/L以下时,预测值误差增大,高于(83.10±7.36%); 当NO-2-N超过120 mg/L时,电流异常增大,预测值误差也随之升至(93.12±6.33%)。由以上结果可知,利用反应液实测的电导率值和电流值作为传感信号,可以实时反映硝化过程NO-2-N质量浓度变化,但与模拟废水相比,预测值误差较大(高于10%限值),适用的NO-2-N质量浓度范围也相对较窄。这可能是因为,硝化反应液组成比模拟废水更为复杂,除了可溶性离子成分外,还含有大量絮体污泥和微小气泡,这些组分都会对工作电极表面的离子迁移和扩散产生影响,从而干扰CA电流,导致传感误差增大[41-42]。
图6 硝化过程中质量浓度与CA电流及电导率的关系
Fig.6 Relationship between NO-2-N mass concentration, CA current and conductivity during nitrification process
3.4 ANAMMOX过程亚硝酸盐质量浓度的电化学传感
ANAMMOX过程中,AnAOB消耗NH+4和NO-2,将绝大部分氮素转化为N2,并生成部分NO-3; 另外,AnAOB还同化少量HCO-3和H+,以合成细胞物质[40]404。由式(15)可知,NH+4和NO-2的消耗量远大于HCO-3,是引起反应液电导率变化的主要因素。

对不同质量浓度的模拟废水进行批式ANAMMOX试验,结果如图7(a)、(c)、(e)所示。试验前期(0~6 h,0~12 h,0~7.5 h),基质质量浓度较高,ANAMMOX速率较快,容积去除速率分别为7.52、7.11、13.46 mg/(L·h)(因试验日期和污泥含量有差异,ANAMMOX速率有所变化); NH+4-N质量浓度分别从21.08、51.96、105.39 mg/L降至6.59、13.24、20.10 mg/L,去除率为68.7%、74.5%、80.9%; NO-2-N质量浓度分别从29.99、78.09、141.15 mg/L降至6.59、23.49、24.79 mg/L,去除率为78.1%、69.9%、82.4%。试验后期(6~12 h、12~24 h、7.5~25 h),随着基质质量浓度降低,ANAMMOX速率变慢,容积去除速率分别降至1.28、1.75、1.92 mg/(L·h); NH+4-N质量浓度分别从6.59、13.24、20.10 mg/L缓慢降至0 mg/L,去除率达100%; NO-2-N质量浓度分别从4.90、23.49、24.79 mg/L降至0.84、5.85、1.39 mg/L,去除率分别为87.3%、75.1%、94.4%。NO-3-N质量浓度由约0 mg/L分别逐步升高至5.98、13.95、23.91 mg/L。ANAMMOX为产碱过程,试验过程中,pH值分别由8.11、8.16、8.37升至8.41、8.55、8.90。随着NH+4和NO-2转化为N2,反应液电导率同步降低,试验前期ANAMMOX速率较高,电导率随之快速下降,分别由1.90、3.07、4.31 mS/cm降至1.75、2.50、2.86 mS/cm; 试验后期,ANAMMOX速率明显下降,电导率下降也明显变缓,分别由1.75、2.50、2.86 mS/cm降至1.68、2.11、2.67 mS/cm。
CA测试Iκ-t曲线如图7(b)、(d)、(f)所示,试验前期,随着NO-2-N质量浓度快速下降,电流同步从0.025、0.052、0.101 mA快速降至0.006、0.019、0.027 mA; 试验后期,随着NO-2-N质量浓度降速减慢,电流也同步从0.006、0.019、0.027 mA缓慢降至0.000 4、0.007、0.006 mA。电流的变化过程与NO-2-N质量浓度的变化过程具有较高的同步性,通过电流值可实时反映ANAMMOX反应动态进程。
图7 ANAMMOX过程中NO-2-N质量浓度与CA电流及电导率的关系
Fig.7 Relationship between NO-2-N mass concentration, CA current and conductivity during ANAMMOX process
将测得的电流值和电导率值代入式(13),可得NO-2-N质量浓度预测值(图7(b)、(d)、(f))。将预测值与实测值进行比较,结果发现:NO-2-N质量浓度为5~34 mg/L时,预测值误差分别为(16.27±1.63%)、(16.71±2.05%)、(16.10±1.77%); NO-2-N质量浓度为35~130 mg/L时,预测值误差为(5.61±0.55%)(图7(d))、(4.08±0.47%)(图7(f)); 而当NO-2-N质量浓度低于5 mg/L或高于130 mg/L时,预测值误差将超过(84.44±7.65%),说明此时无法准确反映反应液NO-2-N质量浓度。由以上结果可知,利用反应液的实测电导率值和电流值作为传感信号,可以实时反映ANAMMOX过程NO-2-N质量浓度变化,虽然预测值的误差较模拟废水高,但是优于硝化过程。ANAMMOX过程未进行曝气,反应液不含微小气泡,而且污泥为颗粒态,对工作电极表面的离子迁移和扩散影响较小,因此NO-2-N预测值误差也较硝化过程小。
4 结 论用CV法和CA法研究了硝化和厌氧氨氧化模拟废水及反应液中亚硝酸盐的电化学氧化信号及其影响因素,得到了以下结论:
1)模拟废水CV测试峰电流Ip与废水NO-2-N质量浓度及ν1/2成正比,pH和电导率κ变化不会对Ip产生明显影响,通过Ip能较好地反映模拟废水实际NO-2-N质量浓度,但是CV测试用时较长,难以实时反映亚硝酸盐质量浓度变化;
2)模拟废水CA测试稳态电流Iκ和κ对NO-2-N质量浓度变化响应迅速,以Iκ和κ作为传感信号,可以较为准确地反映NO-2-N质量浓度变化;
3)反应液Iκ和κ变化与硝化和ANAMMOX过程具有较强相关性,以Iκ和κ作为传感信号,可以实时反映硝化和ANAMMOX反应动态进程及NO-2-N质量浓度变化情况。
- [1] 何理,徐丽,卢宏玮,等.1990~2018年长江经济带农田氮素平衡转变特征[J].中国环境科学,2021,41(10):4820.
- [2] HORD N G. Regulation of dietary nitrate and nitrite:balancing essential physiological roles with potential health risks[M]. Berlin:Springer International Publishing, 2011:153.
- [3] RANGEL-BUITRAGO N, GALGANI F, NEAL W J. Addressing the global challenge of coastal sewage pollution[J]. Marine Pollution Bulletin, 2024,201:1.
- [4] SUN S P, NACHER C P, MERKEY B, et al. Effective biological nitrogen removal treatment processes for domestic wastewaters with low C/N ratios:a review[J]. Environmental Engineering Science, 2010, 27(2):111.
- [5] 孙婷婷,涂耀仁,罗鹏程,等.城市水体氮污染类型及同位素溯源研究[J].上海师范大学学报(自然科学版),2023,52(1):146.
- [6] CANO V, NOLASCO M A, KURT H, et al. Comparative assessment of energy generation from ammonia oxidation by different functional bacterial communities[J]. Science of the Total Environment, 2023, 869:1.
- [7] KARTAL B, KUENEN J G, VAN LOOSDRECHT M C M. Sewage treatment with anammox[J]. Science, 2010, 328(5979):702.
- [8] FENG D B, HE Y X, LU W K, et al. Achieving stable advanced nitrogen removal from mainstream municipal wastewater using integrated strategies in partial nitrification anammox(PNA)granular hybrid system[J]. Chemical Engineering Journal, 2024, 486:1.
- [9] ZHANG Y X, DENG J Y, XIAO X, et al. Insights on pretreatment technologies for partial nitrification/anammox processes:a critical review and future perspectives[J]. Bioresource Technology, 2023, 384:1.
- [10] 聂铭,李振轮.水体中亚硝酸盐积累的生物过程及影响因素研究进展[J].生物工程学报,2020,36(8):1493.
- [11] BRATTON A C, MARSHALL E K. A new coupling component for sulfanilamide determination[J]. Journal of Biological Chemistry, 1939, 128(2):537.
- [12] ZHANG K G, LI S Y, LIU C, et al. A hydrophobic deep eutectic solvent-based vortex-assisted dispersive liquid-liquid microextraction combined with HPLC for the determination of nitrite in water and biological samples[J]. Journal of Separation Science, 2018, 42(2):574.
- [13] 任朝兴,龙慧琴,刘燕,等.干扰物质对气相分子吸收光谱法测定水中亚硝酸盐氮的影响探讨[J].中国无机分析化学,2022,12(5):65.
- [14] YIN H Y, WAN Y, WANG L. Au/NiO/multi-walled carbon nanotubes nanocomposite electrode for nitrite electrochemical determination[J]. Journal of Nanoscience and Nanotechnology, 2019(8):5279.
- [15] FERLAZZO A, BRESSI V, ESPRO C, et al. Electrochemical determination of nitrites and sulfites by using waste-derived nanobiochar[J]. Journal of Electroanalytical Chemistry, 2023, 928:1.
- [16] LI B, MENG T H, XIE X M, et al. Fe-based composites-enabled electrochemical sensors for nitrite detection:a review[J]. Materials Today Chemistry, 2023, 33:1.
- [17] CANALES C, ANTILÉN M, CHAPA M, et al. Electro-oxidation of nitrite using an oxidized glassy carbon electrode as amperometric sensor[J]. Electrocatalysis, 2015, 6(3):300.
- [18] KOZUB B R, REES N V, COMPTON R G. Electrochemical determination of nitrite at a bare glassy carbon electrode:why chemically modify electrodes[J]. Sensors and Actuators B:Chemical, 2012, 143(2):539.
- [19] ALAM M S, RAHMAN M M, MARWANI H M, et al. Insights of temperature dependent catalysis and kinetics of electro-oxidation of nitrite ions on a glassy carbon electrode[J]. Electrochimica Acta, 2020, 362:1.
- [20] 谢作甫,郑平,厉巍,等.ANAMMOX过程性能与电导率变化[J].化工学报,2013,64(7):2633.
- [21] American Public Health Association. Standard methods for the examination of water and wastewater[M]. Washington D C:American Public Health Association, 1998:1.
- [22] 王宇,陈雅岚,冯金玥,等.活化玻碳电极直接快速检测亚硝酸盐[J].分析科学学报,2019,35(2):261.
- [23] GUIDELLI R, PERGOLA F, RASPI G. Voltammetric behavior of nitrite ion on platinum in neutral and weakly acidic media[J]. Analytical Chemistry, 1972, 44(4):745.
- [24] FENG R Q, FAN Y, FANG Y, et al. Morphological effects of Au nanoparticles on electrochemical sensing platforms for nitrite detection[J]. Molecules, 2023, 28:1.
- [25] BEIGMORADI F, BEITOLLAHI H.Voltammetric determination of nitrite using modified glassy carbon electrode[J]. Surface Engineering and Applied Electrochemistry, 2024, 60(1):15.
- [26] JIANG Y N, LUO H Q, LI N B. Determination of nitrite with a nano-gold modified glassy carbon electrode by cyclic voltammetry[J]. International Journal of Environmental Analytical Chemistry, 2007, 87(4):295.
- [27] 郑冬云,刘晓军,朱珊莹,等.电化学传感法测定水中亚硝酸盐[J].中国环境监测,2014,30(4):140.
- [28] NAJMEH S, MEISSAM N. Nanoraspberry-like copper/reduced graphene oxide as new modifier for simultaneous determination of benzenediols isomers and nitrite[J]. Analytica Chimica Acta, 2019, 1056:16.
- [29] 陈莹,庄国顺,郭志刚.近海营养盐和微量元素的大气沉降[J].地球科学进展,2010,25(7):682.
- [30] BARD J A, FAULKNER L R. Electrochemical methods:fundamentals and applications[M]. Hoboken:John Wiley&Sons, 2001:97.
- [31] 何尚卫,张雷,张超,等.工业污水处理厂生化出水氨氮周年变化及原因分析[J].化工进展,2018,37(9):3691.
- [32] 韩雪恪,王峥嵘,彭永臻,等.几种重要因素对厌氧氨氧化过程的影响综述[J].中国环境科学,2023,43(5):2220.
- [33] 中华人民共和国工业和信息化部.循环伏安溶出分析仪校准规范:JJF 0043—2019[S].北京:中国发展出版社,2020:1.
- [34] 黑龙江市场监督管理局.水质 游离氯和总氯的测定 电化学法:DB23/T 2751—2020[S/OL].[2024-06-15].http://wap.csres.com/detail/360258.html.
- [35] 戴兴德,张爱菊,张小林.活化玻碳电极直接测定牛奶中的亚硝酸盐[J].中国卫生检验杂志,2015(19),25:3266.
- [36] ZHAO K M, ZHANG Z Y, ZHOU Y H, et al. Ag-CeO2 based on electrochemical sensor for high-efficient on-site detection of nitrite in aquaculture water and beverages[J]. Molecules, 2024, 29:1.
- [37] ZHOU L, WANG J P, LING G, et al. An amperometric sensor based on ionic liquid and carbon nanotube modified composite electrode for the determination of nitrite in milk[J]. Sensors and Actuators B:Chemical, 2013, 181:65.
- [38] FENG J J, ZHANG P P, WANG A J, et al. One-pot hydrothermal synthesis of uniform β -MnO2 nanorods for nitrite sensing[J]. Journal of Colloid and Interface Science, 2011, 359(1):1.
- [39] MARLINDA A R, PANDIKUMAR A, YUSOFF N, et al. Electrochemical sensing of nitrite using a glassy carbon electrode modified with reduced functionalized graphene oxide decorated with flower-like zinc oxide[J]. Microchimica Acta, 2015, 182:1113.
- [40] 郑平,冯孝善.废物生物处理[M].北京:高等教育出版社,2006:373.
- [41] 褚俊杰,王宗旭,白璐,等.电催化反应电极界面纳微气泡多尺度研究进展[J].中国科学:化学,2024,54(6):892.
- [42] 王佳,李相波,王伟.海水环境中微生物附着对钝性金属开路电位的影响[J].中国腐蚀与防护学报,2004(5):7.
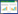 图 1 模拟废水的CV测试曲线
Fig.1 CV curves of simulated wastewater
图 1 模拟废水的CV测试曲线
Fig.1 CV curves of simulated wastewater